
PG13宿主细胞DNA残留检测试剂盒及检测方法.pdf

猫巷****奕声






亲,该文档总共14页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料
PG13宿主细胞DNA残留检测试剂盒及检测方法.pdf
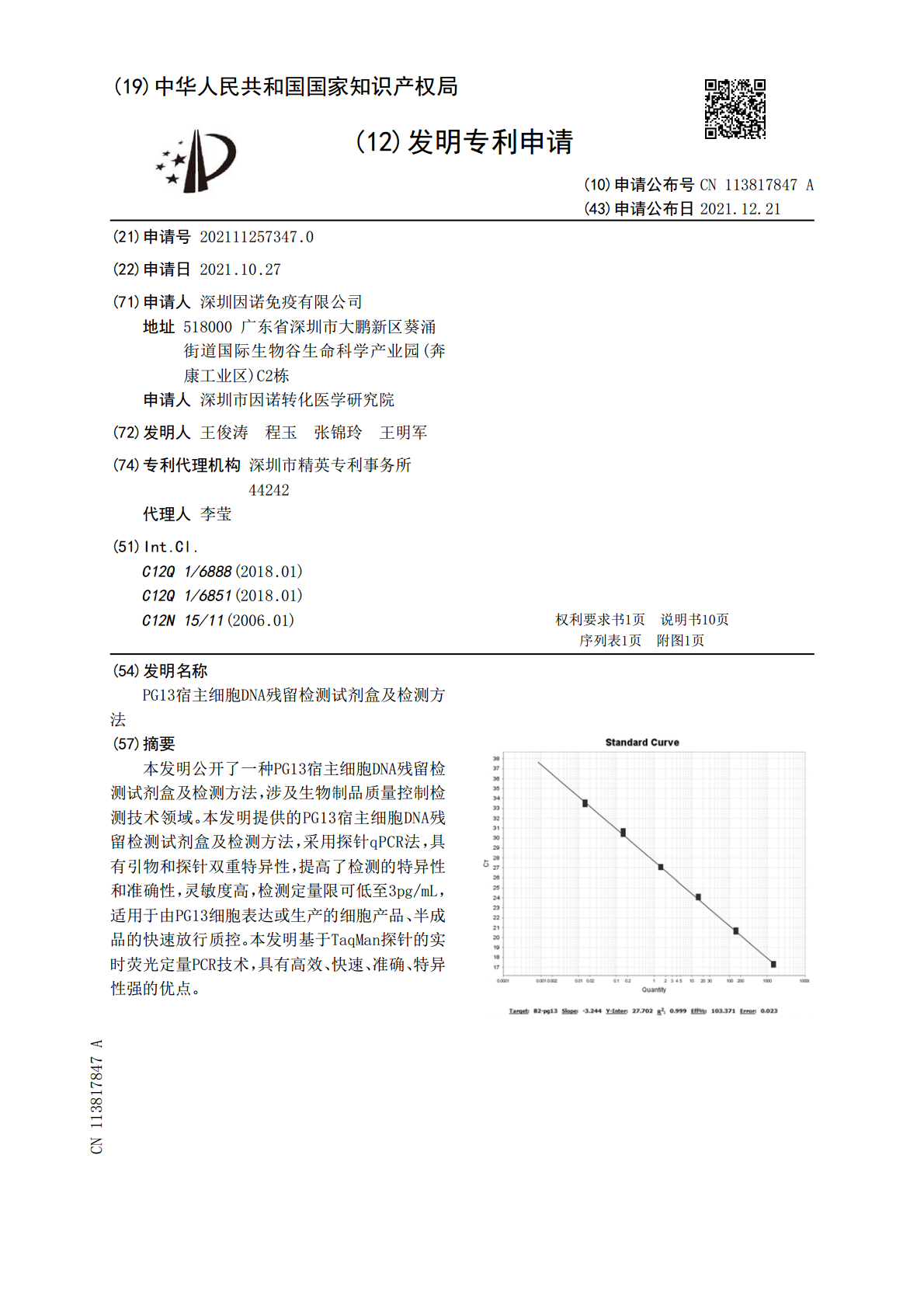
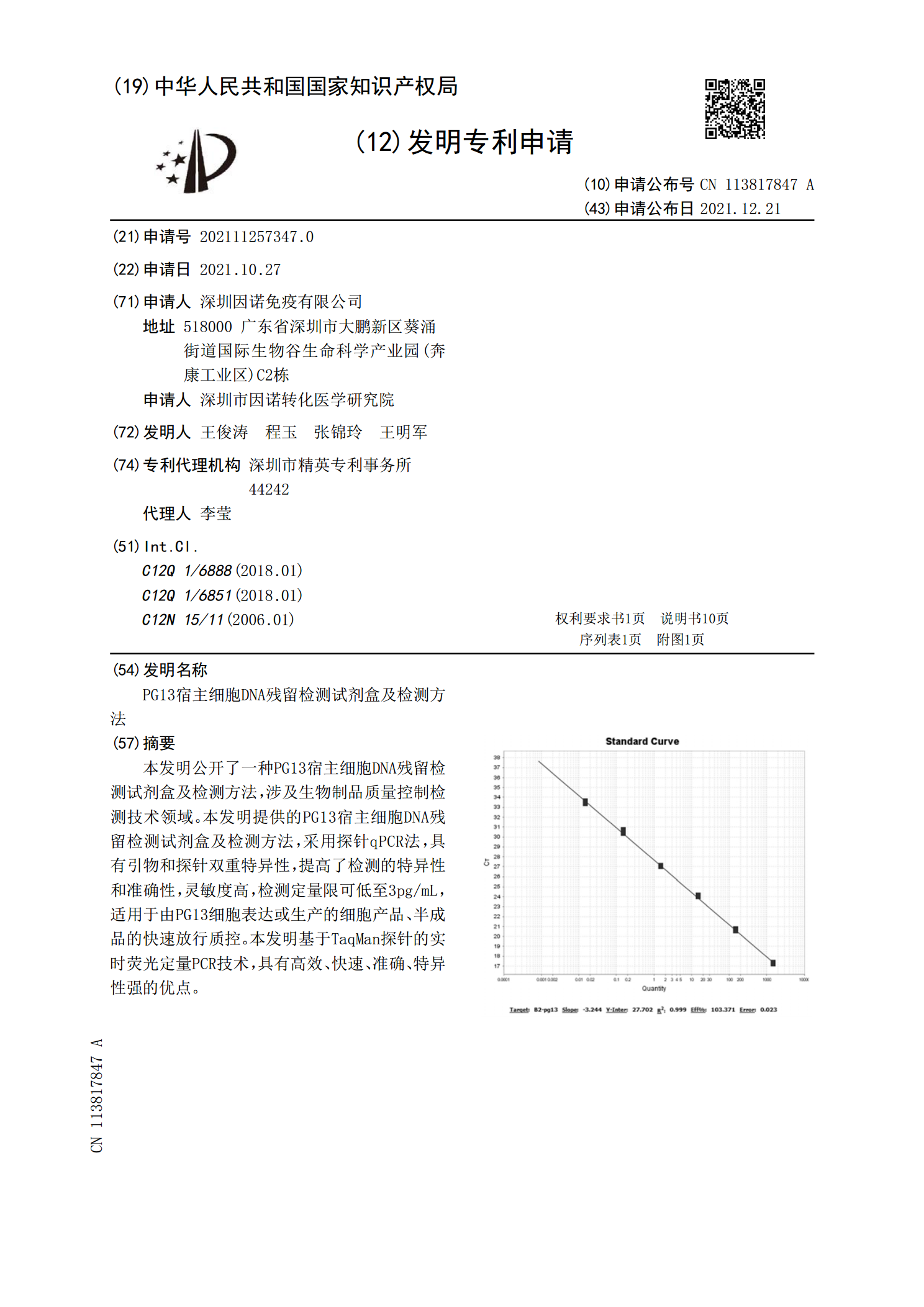
本发明公开了一种PG13宿主细胞DNA残留检测试剂盒及检测方法,涉及生物制品质量控制检测技术领域。本发明提供的PG13宿主细胞DNA残留检测试剂盒及检测方法,采用探针qPCR法,具有引物和探针双重特异性,提高了检测的特异性和准确性,灵敏度高,检测定量限可低至3pg/mL,适用于由PG13细胞表达或生产的细胞产品、半成品的快速放行质控。本发明基于TaqMan探针的实时荧光定量PCR技术,具有高效、快速、准确、特异性强的优点。

一种检测CHO细胞宿主蛋白残留的试剂盒及检测方法.pdf
本发明涉及生物医学分析技术领域,尤其涉及一种检测CHO细胞宿主蛋白残留的试剂盒。本发明试剂盒利用CHO宿主细胞蛋白作为标准品和抗原制备抗体,具有特异性高、灵敏度高、检测效率高的特点,可同时检测多个样品,定量限达到5ppm,使用设备简单,操作方便,检测成本低。
检测疫苗中MDCK细胞DNA残留的试剂盒.pdf
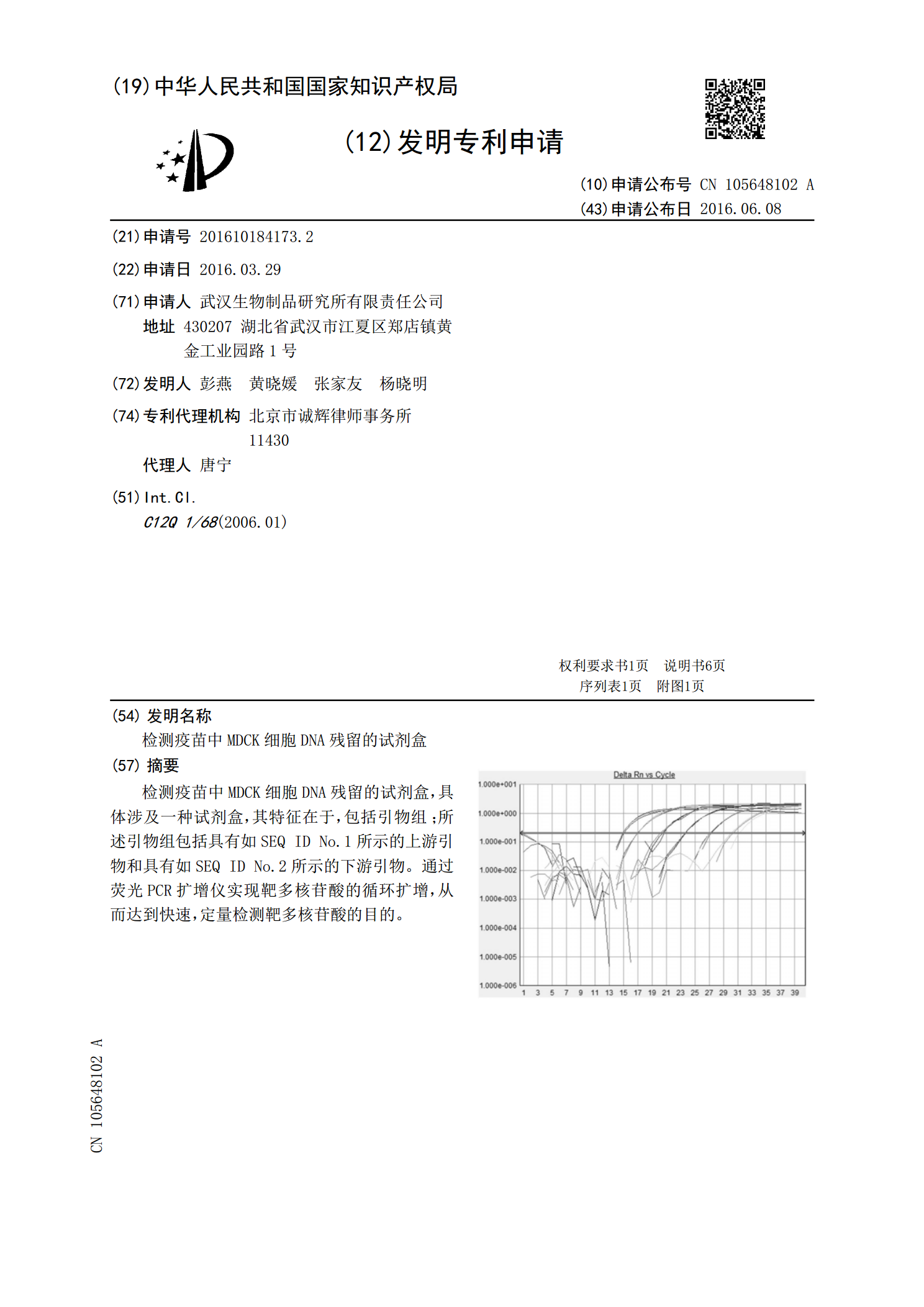
检测疫苗中MDCK细胞DNA残留的试剂盒,具体涉及一种试剂盒,其特征在于,包括引物组;所述引物组包括具有如SEQ?ID?No.1所示的上游引物和具有如SEQ?ID?No.2所示的下游引物。通过荧光PCR扩增仪实现靶多核苷酸的循环扩增,从而达到快速,定量检测靶多核苷酸的目的。

一种TaqMan探针法的CHO宿主细胞DNA残留检测试剂盒及其应用.pdf
本发明涉及一种TaqMan探针法的CHO宿主细胞DNA残留检测试剂盒及其应用,所述的试剂盒包含:CHODNAControl,DNADilutionBuffer,2xMaxDetectqPCRMix,10xCHODetectionMix;本发明还涉及上述试剂盒的用途和使用方法。试剂盒中包含制备标准曲线的DNA参考品CHODNAControl,已溯源至国家标准品,利用Taqman探针定量PCR方法,能快速、特异地检测fg水平的CHO宿主细胞的DNA残留。本试剂盒适用于生物制药的中间产物
一种用于检测CHO细胞DNA残留的引物、试剂盒及检测方法.pdf
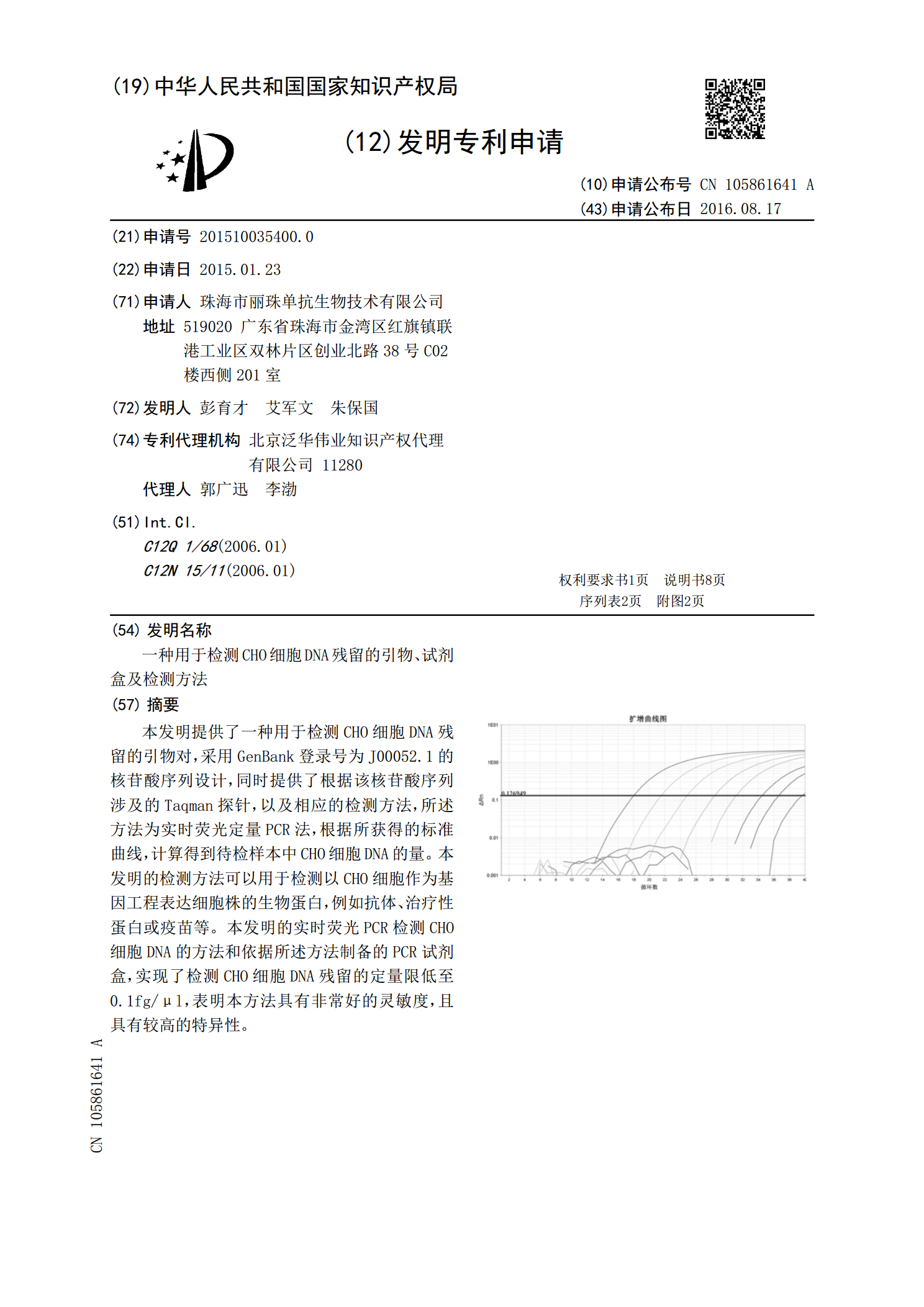
本发明提供了一种用于检测CHO细胞DNA残留的引物对,采用GenBank登录号为J00052.1的核苷酸序列设计,同时提供了根据该核苷酸序列涉及的Taqman探针,以及相应的检测方法,所述方法为实时荧光定量PCR法,根据所获得的标准曲线,计算得到待检样本中CHO细胞DNA的量。本发明的检测方法可以用于检测以CHO细胞作为基因工程表达细胞株的生物蛋白,例如抗体、治疗性蛋白或疫苗等。本发明的实时荧光PCR检测CHO细胞DNA的方法和依据所述方法制备的PCR试剂盒,实现了检测CHO细胞DNA残留的定量限低至0.
