
分子结构和分子间力精学习.pptx

快乐****蜜蜂









亲,该文档总共69页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

分子结构和分子间力精学习.pptx
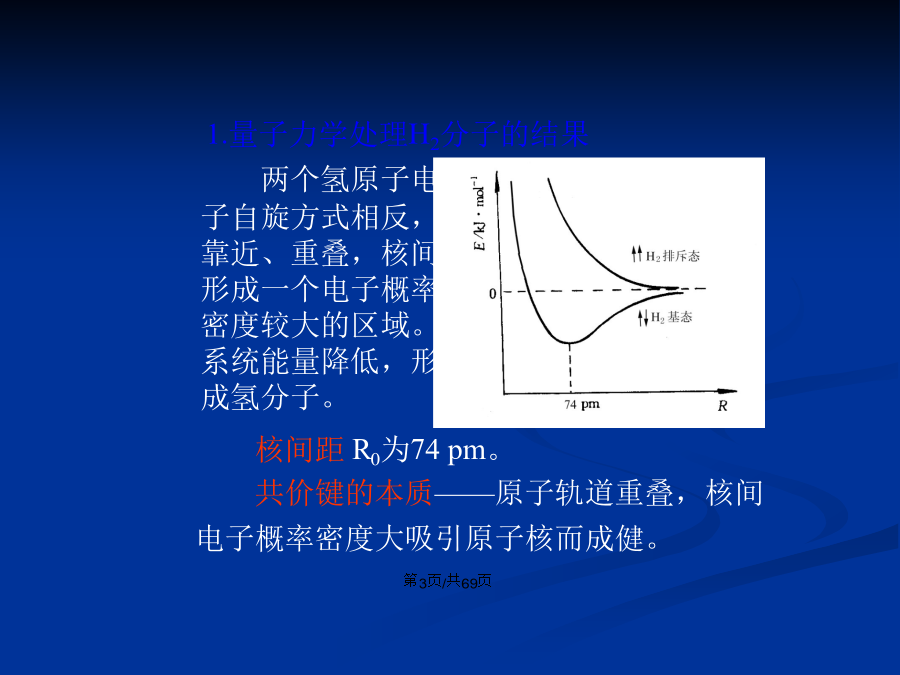
会计学2.1.1共价键的本质与特点离子键理论1.量子力学处理H2分子的结果2.价键理论基本要点与共价键的特点1.σ键:原子轨道沿核间联线方向进行同号重叠(头碰头)。2.π键:两原子轨道垂直核间联线并相互平行进行同号重叠(肩并肩)。3.配位键形成条件:成键原子一方有孤对电子,另一方有空轨道。§2.1.3键参数在双原子分子中,于100kPa下将气态分子断裂成气态原子所需要的能量。H2O(g)=2H(g)+O(g)键能与标准摩尔反应焓变分子中两原子核间的平衡距离称为键长。例如,H2分子,l=74pm。由表数据可

分子结构和分子间力精学习教案.ppt
2.1.1共价键的本质(běnzhì)与特点离子键理论(lǐlùn)1.量子力学处理(chǔlǐ)H2分子的结果2.价键理论基本(jīběn)要点与共价键的特点1.σ键:原子轨道沿核间联线方向(fāngxiàng)进行同号重叠(头碰头)。2.π键:两原子轨道垂直核间联线并相互平行进行(jìnxíng)同号重叠(肩并肩)。3.配位键形成(xíngchéng)条件:成键原子一方有孤对电子,另一方有空轨道。§2.1.3键参数(cānshù)在双原子分子中,于100kPa下将气态分子断裂(duànliè)成气态原

分子结构和分子间力、氢键.ppt
单元二物质结构基础复习提问:1、理解价键理论,键能、键长、键角的概念及共价键的类型2、理解杂化轨道理论第二节分子结构和分子间力、氢键一、离子键×离子键形成条件2、离子键的特征二、共价键分子式电子式结构式Eg写出甲烷、乙烯、乙炔的结构式2、价键理论(1)量子力学处理H2分子的结果两个氢原子电子自旋方式相反,靠近、重叠,核间形成一个电子概率密度较大的区域。系统能量降低,形成氢分子。H2中的化学键,可以认为是电子自旋相反成对,结果使体系的能量降低。小结:(2)价键理论基本要点P29(3)共价键的特性②具有方向性

工科无机化学中“分子结构和分子间力”的教学思考与探索.docx
工科无机化学中“分子结构和分子间力”的教学思考与探索分子结构和分子间力在工科无机化学中占据着重要的位置,对于学生的学习和掌握具有重要意义。本文将从教学思考和探索两个方面,分析工科无机化学中分子结构和分子间力的教学策略和方法,以期培养学生的综合素质和能力。在教学思考方面,首先需要明确学习目标和学生需求。无机化学作为工科的一门重要基础课程,学生在学习过程中需要掌握无机化合物的基本概念、分类和特性,并能够理解和解释分子结构及分子间力对物质性质的影响。因此,在教学过程中要注重培养学生的概念和理论思维能力,并通过实

分子结构及分子间氢键.ppt
§10.2共价键五、分子轨道理论简介1、原子组成分子后,电子不再从属于某个原子,而是在整个分子空间区域(分子轨道)内运动,其运动状态可用分子轨道Ψ表示。2、分子轨道是原子轨道的线性组合,有几个原子轨道参与组合就能形成几个分子轨道。3、为了有效地组合成分子轨道,要求成键的各原子轨道必须符合以下三个原则:对称:绕键轴旋转1800,轨道形状和符号不变。如:s、px、dx2-y2、dz2轨道都有对称性,可相互组合成分子轨道。π对称:绕键轴旋转1800,轨道形状不变而符号相反。如:py、pz、dxy、dyzd
