
分子结构及分子间氢键.ppt

kp****93




亲,该文档总共34页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

分子结构及分子间氢键.ppt
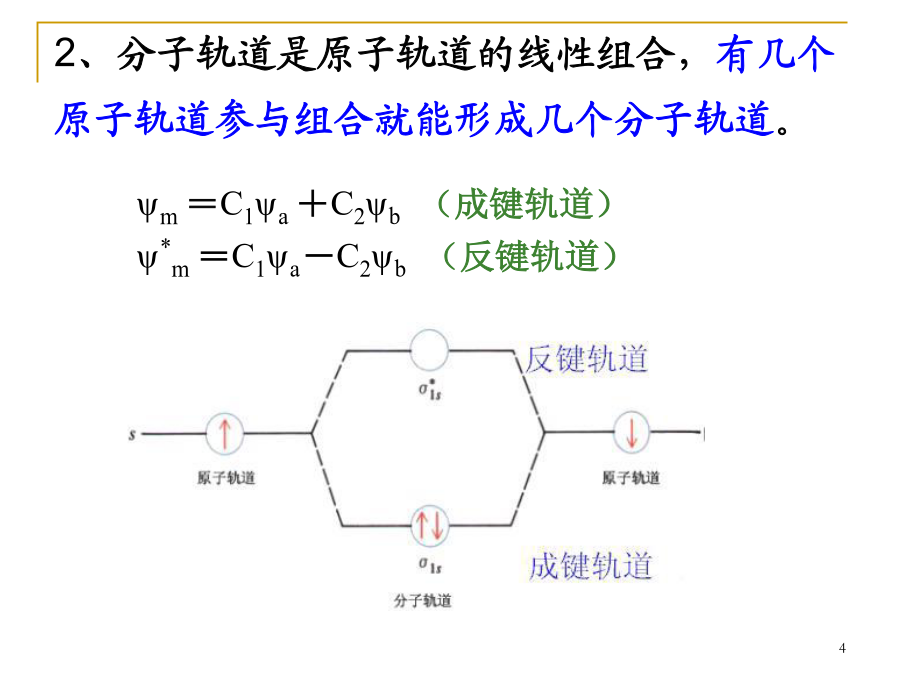
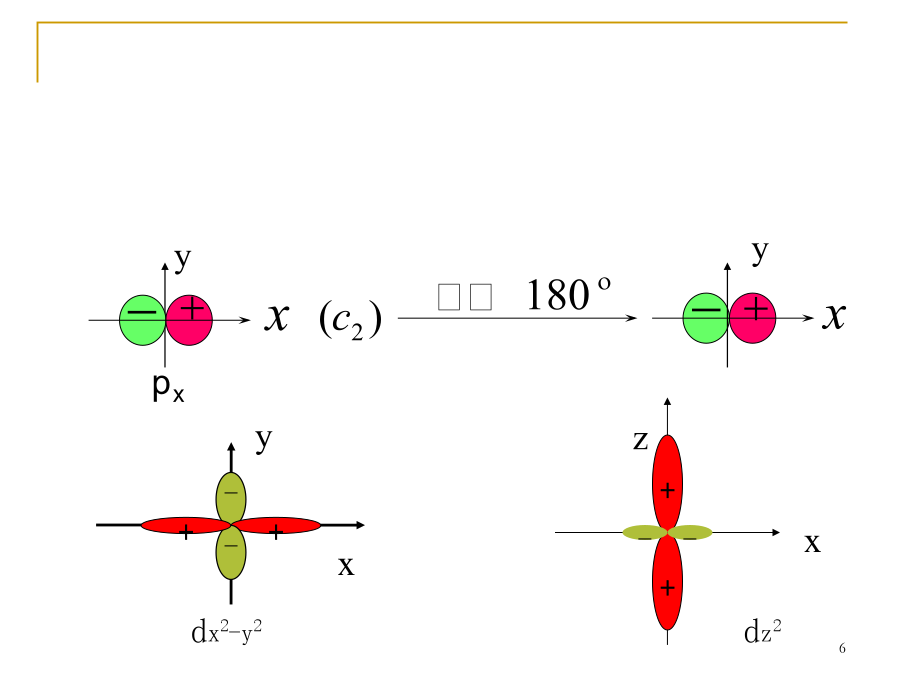
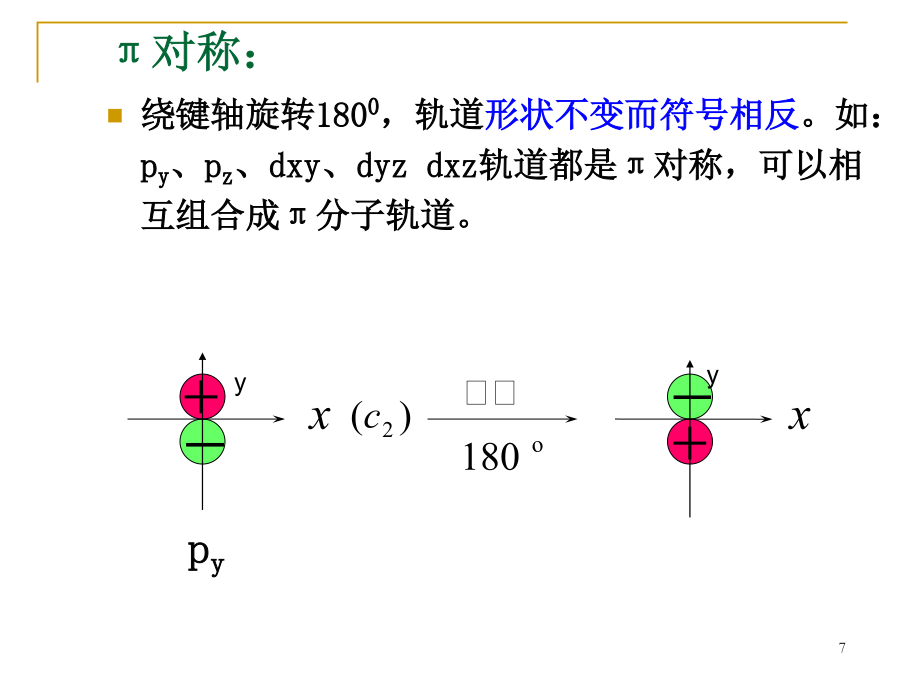
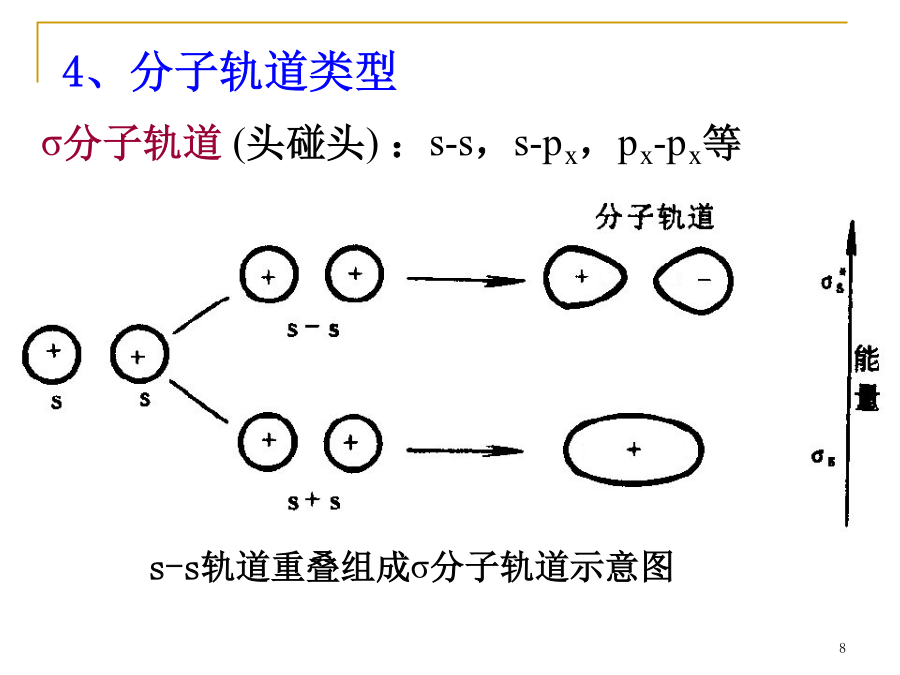
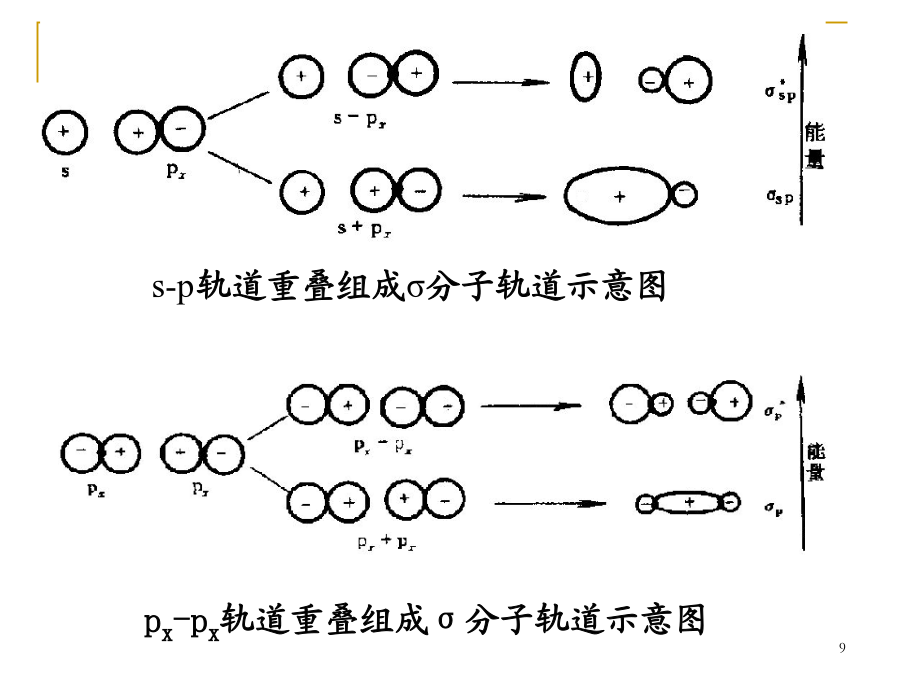
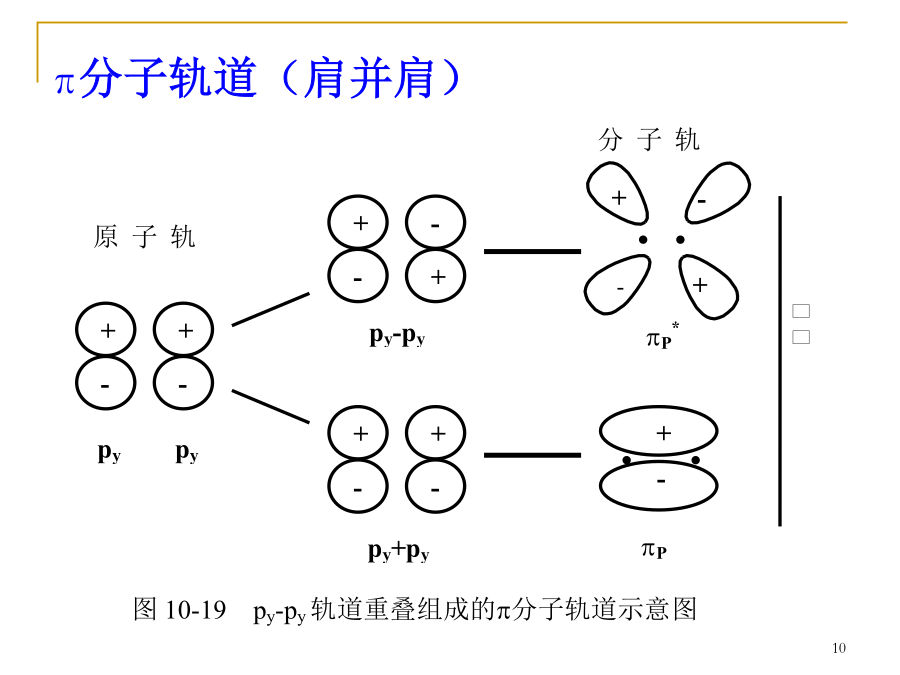
§10.2共价键五、分子轨道理论简介1、原子组成分子后,电子不再从属于某个原子,而是在整个分子空间区域(分子轨道)内运动,其运动状态可用分子轨道Ψ表示。2、分子轨道是原子轨道的线性组合,有几个原子轨道参与组合就能形成几个分子轨道。3、为了有效地组合成分子轨道,要求成键的各原子轨道必须符合以下三个原则:对称:绕键轴旋转1800,轨道形状和符号不变。如:s、px、dx2-y2、dz2轨道都有对称性,可相互组合成分子轨道。π对称:绕键轴旋转1800,轨道形状不变而符号相反。如:py、pz、dxy、dyzd

分子结构和分子间力、氢键.ppt
单元二物质结构基础复习提问:1、理解价键理论,键能、键长、键角的概念及共价键的类型2、理解杂化轨道理论第二节分子结构和分子间力、氢键一、离子键×离子键形成条件2、离子键的特征二、共价键分子式电子式结构式Eg写出甲烷、乙烯、乙炔的结构式2、价键理论(1)量子力学处理H2分子的结果两个氢原子电子自旋方式相反,靠近、重叠,核间形成一个电子概率密度较大的区域。系统能量降低,形成氢分子。H2中的化学键,可以认为是电子自旋相反成对,结果使体系的能量降低。小结:(2)价键理论基本要点P29(3)共价键的特性②具有方向性
水分子间的氢键.ppt
图1-8水分子间的氢键晶体结构晶体的概念构成晶体的基本微粒和作用力离子晶体晶体类型的判断课堂练习题氯化铯的晶体结构1.氯化钠晶体结构示意图2.氯化铯晶体结构示意图晶胞中微粒个数的分配方法:一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔点、沸点也越高。例如,卤素单质,随着相对分子质量的增大,分子间作用力增大,它们的熔点、沸点也相应升高(如图)。图1-5四卤化碳的熔、沸点与相对分子质量的关系图1-8水分子间的氢键图1-7HF分子间的氢键在HF分子中,由于F原子吸引电子的能力很

分子间力和氢键.ppt
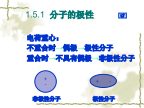
1.5分子间力和氢键电荷重心:不重合时→偶极→极性分子重合时→不具有偶极→非极性分子电偶极矩分子极性的类型2.固有偶极—产生取向力3.瞬时偶极—产生色散作用1.5.2分子间力1.色散力2.诱导力3.取向力——由固有偶极分子间力的特点2.分子间力作用的范围很小(一般是300~500pm)分子间力是短程力,它随着分子间的距离增加,分子间作用力(能)以其六次方的关系减小.因此,在液态或固态的情况下,分子间力比较显著,而在气态时,分子间力很小,往往可忽略.3.分子间力与化学键不同分子间力既无确定方向,又无饱和性.
分子间力和氢键.ppt
电荷重心:不重合时→偶极→极性分子重合时→不具有偶极→非极性分子电偶极矩分子极性的类型2.固有偶极—产生取向力3.瞬时偶极—产生色散作用1.5.2分子间力1.色散力2.诱导力3.取向力——由固有偶极分子间力的特点2.分子间力作用的范围很小(一般是300~500pm)分子间力是短程力,它随着分子间的距离增加,分子间作用力(能)以其六次方的关系减小.因此,在液态或固态的情况下,分子间力比较显著,而在气态时,分子间力很小,往往可忽略.3.分子间力与化学键不同分子间力既无确定方向,又无饱和性.分子间作用力(能)一
