
分子结构和分子间力、氢键.ppt

kp****93










亲,该文档总共75页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

分子结构和分子间力、氢键.ppt
单元二物质结构基础复习提问:1、理解价键理论,键能、键长、键角的概念及共价键的类型2、理解杂化轨道理论第二节分子结构和分子间力、氢键一、离子键×离子键形成条件2、离子键的特征二、共价键分子式电子式结构式Eg写出甲烷、乙烯、乙炔的结构式2、价键理论(1)量子力学处理H2分子的结果两个氢原子电子自旋方式相反,靠近、重叠,核间形成一个电子概率密度较大的区域。系统能量降低,形成氢分子。H2中的化学键,可以认为是电子自旋相反成对,结果使体系的能量降低。小结:(2)价键理论基本要点P29(3)共价键的特性②具有方向性

分子结构及分子间氢键.ppt
§10.2共价键五、分子轨道理论简介1、原子组成分子后,电子不再从属于某个原子,而是在整个分子空间区域(分子轨道)内运动,其运动状态可用分子轨道Ψ表示。2、分子轨道是原子轨道的线性组合,有几个原子轨道参与组合就能形成几个分子轨道。3、为了有效地组合成分子轨道,要求成键的各原子轨道必须符合以下三个原则:对称:绕键轴旋转1800,轨道形状和符号不变。如:s、px、dx2-y2、dz2轨道都有对称性,可相互组合成分子轨道。π对称:绕键轴旋转1800,轨道形状不变而符号相反。如:py、pz、dxy、dyzd

分子间力和氢键.ppt
1.5分子间力和氢键电荷重心:不重合时→偶极→极性分子重合时→不具有偶极→非极性分子电偶极矩分子极性的类型2.固有偶极—产生取向力3.瞬时偶极—产生色散作用1.5.2分子间力1.色散力2.诱导力3.取向力——由固有偶极分子间力的特点2.分子间力作用的范围很小(一般是300~500pm)分子间力是短程力,它随着分子间的距离增加,分子间作用力(能)以其六次方的关系减小.因此,在液态或固态的情况下,分子间力比较显著,而在气态时,分子间力很小,往往可忽略.3.分子间力与化学键不同分子间力既无确定方向,又无饱和性.
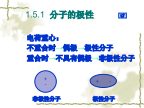
分子间力和氢键.ppt
电荷重心:不重合时→偶极→极性分子重合时→不具有偶极→非极性分子电偶极矩分子极性的类型2.固有偶极—产生取向力3.瞬时偶极—产生色散作用1.5.2分子间力1.色散力2.诱导力3.取向力——由固有偶极分子间力的特点2.分子间力作用的范围很小(一般是300~500pm)分子间力是短程力,它随着分子间的距离增加,分子间作用力(能)以其六次方的关系减小.因此,在液态或固态的情况下,分子间力比较显著,而在气态时,分子间力很小,往往可忽略.3.分子间力与化学键不同分子间力既无确定方向,又无饱和性.分子间作用力(能)一

分子结构和分子间力精学习.pptx
会计学2.1.1共价键的本质与特点离子键理论1.量子力学处理H2分子的结果2.价键理论基本要点与共价键的特点1.σ键:原子轨道沿核间联线方向进行同号重叠(头碰头)。2.π键:两原子轨道垂直核间联线并相互平行进行同号重叠(肩并肩)。3.配位键形成条件:成键原子一方有孤对电子,另一方有空轨道。§2.1.3键参数在双原子分子中,于100kPa下将气态分子断裂成气态原子所需要的能量。H2O(g)=2H(g)+O(g)键能与标准摩尔反应焓变分子中两原子核间的平衡距离称为键长。例如,H2分子,l=74pm。由表数据可
