
PCB沉铜讲义.doc

sy****28





在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

PCB沉铜讲义.doc
沉铜讲义一、沉铜目的:沉铜的目的是利用化学反应原理在孔壁上沉积一层0.3um-0.5um的铜,使原本绝缘的孔壁具有导电性,便于后续板面电镀及图形电镀的顺利进行,从而完成PCB电路网络间的电性互通。二、沉铜原理:利用甲醛在强碱性环境中所具有的还原性并在Pd作用下而使Cu2+被还原成铜。Cu2++2HCHO+4OH三、工艺流程:粗磨→膨胀→除胶渣→三级水洗→中和→二级水洗→除油→稀酸洗→二级水洗→微蚀→预浸→活化→二级水洗→加速→一级水洗→沉铜→二级水洗→板面电镀→幼磨→铜检四、工艺简介:1.粗磨:目的是除去

PCB沉铜工艺及其沉铜架.pdf
本申请提供一种PCB沉铜工艺及其沉铜架。上述的PCB沉铜架包括母篮和子篮,母篮包括第一支架、底座、第二支架及固定杆,第一支架与底座连接,第二支架与底座远离第一支架的一端连接,固定杆分别与第一支架及第二支架连接;子篮包括篮体和悬挂件,悬挂件连接于篮体的一侧,悬挂件用于与固定杆可拆卸挂接,篮体开设有定位凹槽,定位凹槽用于放置PCB。上述的PCB沉铜架操作更加简便且能够减少或避免PCB上下板擦花问题。

在PCB板上沉铜的方法.pdf
本发明涉及PCB板的制造领域,尤其涉及一种在PCB板上沉铜的方法,包括活化工序,所述活化工序包括在不同活化缸内进行的第一次活化和第二次活化,且第二次活化缸的活化强度小于第一次活化缸的活化强度。首先,第一活化起到主力活化的作用,基本满足活化孔壁的效果;第二次活化起到辅助或补充活化的作用,由于第二次活化缸的活化强度相对较低,活化液可以更容易地进入孔内,并对孔壁进行更有效、更充分的活化,在一定程度上较好地弥补了第一次活化可能留下的缺陷,使孔内薄铜、无铜现象出现的几率大大降低。
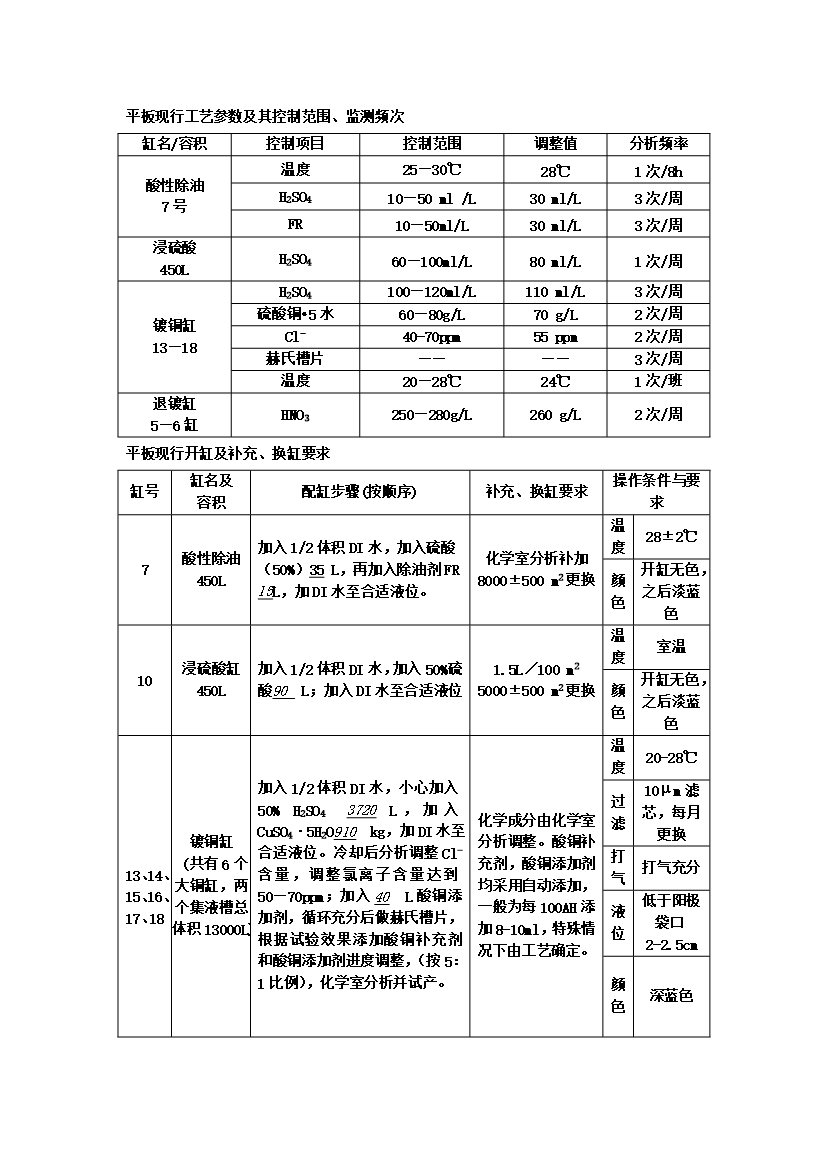
PCB电镀沉铜药水控制工艺.doc
平板现行工艺参数及其控制范围、监测频次缸名/容积控制项目控制范围调整值分析频率酸性除油7号温度25—30℃28℃1次/8hH2SO410—50ml/L30ml/L3次/周FR10—50ml/L30ml/L3次/周浸硫酸450LH2SO460—100ml/L80ml/L1次/周镀铜缸13—18H2SO4100—120ml/L110ml/L3次/周硫酸铜•5水60—80g/L70g/L2次/周Cl-40-70ppm55ppm2次/周赫氏槽片————3次/周温度20—28℃24℃1次/班退镀缸5

PCB电镀沉铜药水控制工艺.docx
编号:时间:2021年x月x日书山有路勤为径学海无涯苦作舟页码:平板现行工艺参数及其控制范围、监测频次缸名/容积控制项目控制范围调整值分析频率酸性除油7号温度25—30℃28℃1次/8hH2SO410—50ml/L30ml/L3次/周FR10—50ml/L30ml/L3次/周浸硫酸450LH2SO460—100ml/L80ml/L1次/周镀铜缸13—18H2SO4100—120ml/L110ml/L3次/周硫酸铜•5水60—80g/L70g/L2次
