
(新课改省份专版)高考化学一轮复习 跟踪检测(四十九)认识层面 晶体结构与性质-人教版高三全册化学试题.doc

婀娜****aj







在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

(新课改省份专版)高考化学一轮复习 跟踪检测(四十九)认识层面 晶体结构与性质-人教版高三全册化学试题.doc
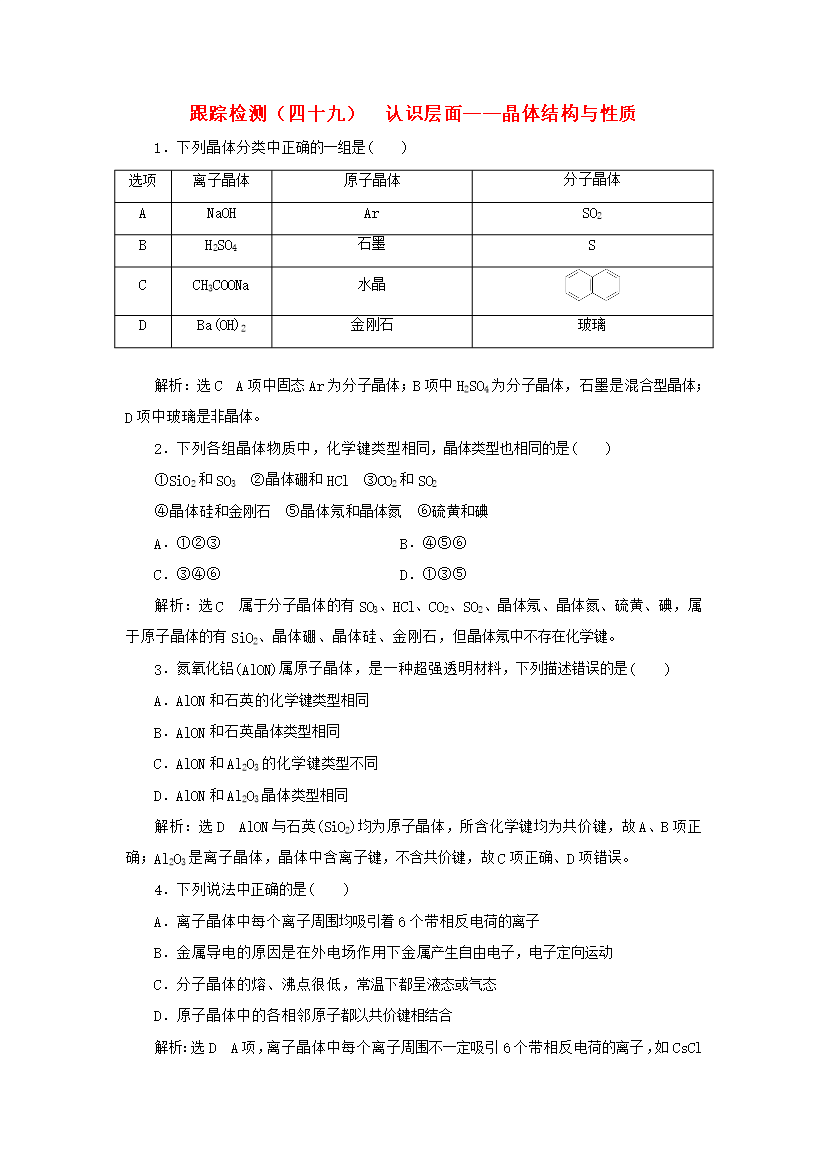
跟踪检测(四十九)认识层面——晶体结构与性质1.下列晶体分类中正确的一组是()选项离子晶体原子晶体分子晶体ANaOHArSO2BH2SO4石墨SCCH3COONa水晶DBa(OH)2金刚石玻璃解析:选CA项中固态Ar为分子晶体;B项中H2SO4为分子晶体,石墨是混合型晶体;D项中玻璃是非晶体。2.下列各组晶体物质中,化学键类型相同,晶体类型也相同的是()①SiO2和SO3②晶体硼和HCl③CO2和SO2④晶体硅和金刚石⑤晶体氖和晶体氮⑥硫黄和碘A.①②③B.④⑤⑥C.③④⑥D.①③⑤解析:选C属于分子晶体
(新课改省份专版)高考化学一轮复习 跟踪检测(四十九)认识层面 晶体结构与性质-人教版高三全册化学试题.doc
跟踪检测(四十九)认识层面——晶体结构与性质1.下列晶体分类中正确的一组是()选项离子晶体原子晶体分子晶体ANaOHArSO2BH2SO4石墨SCCH3COONa水晶DBa(OH)2金刚石玻璃解析:选CA项中固态Ar为分子晶体;B项中H2SO4为分子晶体石墨是混合型晶体;D项中玻璃是非晶体。2.下列各组晶体物质中化学键类型相同晶体类型也相同的是()①SiO2和SO3②晶体硼和HCl③CO2和SO2④晶体硅和金刚石⑤晶体氖和晶体氮⑥硫黄和碘A.①②③B.④⑤⑥C.③④⑥

(新课改省份专版)高考化学一轮复习 跟踪检测(四十八)认识层面 分子结构与性质-人教版高三全册化学试题.doc
跟踪检测(四十八)认识层面——分子结构与性质1.下列说法中不正确的是()A.σ键比π键重叠程度大,形成的共价键强B.两个原子之间形成共价键时,最多有一个σ键C.气体单质中,一定有σ键,可能有π键D.N2分子中有一个σ键,两个π键解析:选C单键均为σ键,双键和三键中各存在一个σ键,其余均为π键。稀有气体单质中,不存在化学键。2.实现下列变化,需克服相同类型作用力的是()A.石墨和氯化钠分别受热熔化B.冰的熔化和水的分解C.NaCl和HCl溶于水D.干冰和碘的升华解析:选D石墨熔化破坏共价键,NaCl熔化破坏

(新课改省份专版)高考化学一轮复习 跟踪检测(四十八)认识层面 分子结构与性质-人教版高三全册化学试题.doc
跟踪检测(四十八)认识层面——分子结构与性质1.下列说法中不正确的是()A.σ键比π键重叠程度大形成的共价键强B.两个原子之间形成共价键时最多有一个σ键C.气体单质中一定有σ键可能有π键D.N2分子中有一个σ键两个π键解析:选C单键均为σ键双键和三键中各存在一个σ键其余均为π键。稀有气体单质中不存在化学键。2.实现下列变化需克服相同类型作用力的是()A.石墨和氯化钠分别受热熔化B.冰的熔化和水的分解C.NaCl和HCl溶于水D.干冰和碘的升华解析:选D石墨熔化破坏共价键NaCl熔化破坏离子

(新课改省份专版)高考化学一轮复习 8.4 认识层面 晶体结构与性质学案(含解析)-人教版高三全册化学学案.doc
第4课时认识层面——晶体结构与性质知识点一晶体和晶胞1.晶体与非晶体(1)晶体与非晶体的区别比较晶体非晶体结构特征结构粒子周期性有序排列结构粒子无序排列性质特征自范性有无熔点固定不固定异同表现各向异性各向同性二者区别方法间接方法测定其是否有固定的熔点科学方法对固体进行X射线衍射实验(2)获得晶体的三条途径①熔融态物质凝固。②气态物质冷却不经液态直接凝固(凝华)。③溶质从溶液中析出。2.晶胞(1)概念:晶胞是描述晶体结构的基本单元。(2)晶体中晶胞的排列——无隙并置①无隙:相邻晶胞之间没有任何间隙。②并置
