
课件-全国-2006_溶液浓度的有关计算 新课标 人教版.rar

一只****爱敏







亲,该文档总共23页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

课件-全国-2006_溶液浓度的有关计算 新课标 人教版.rar
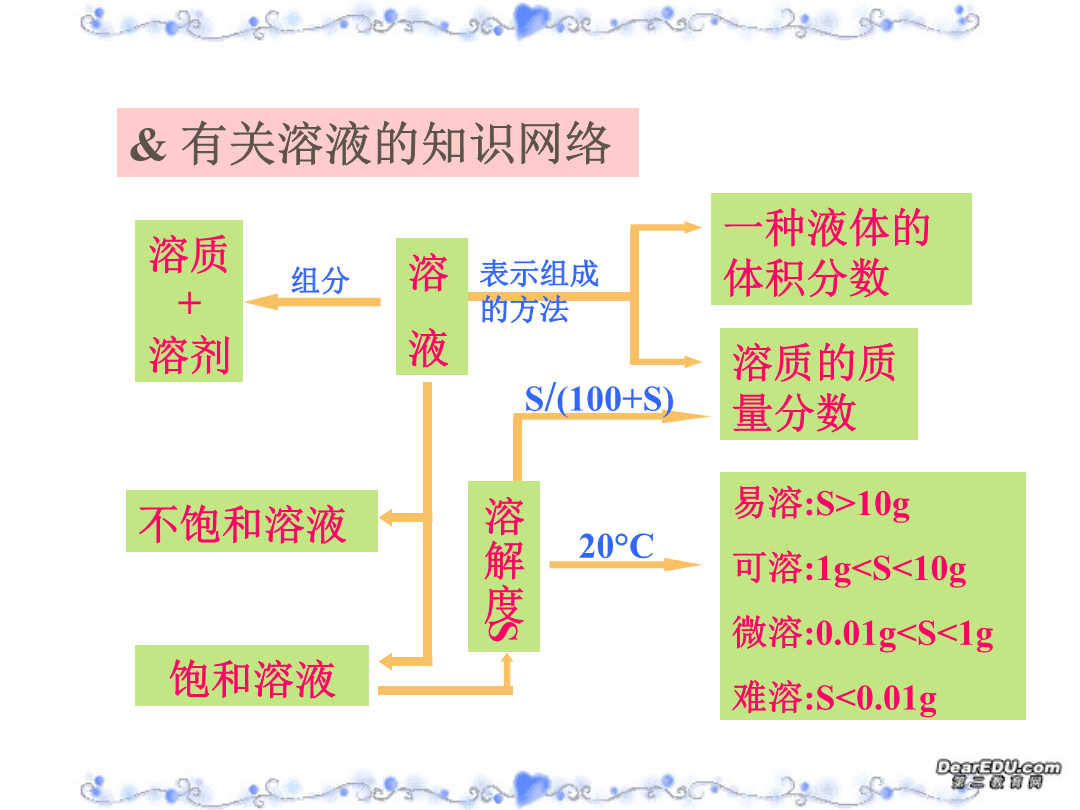
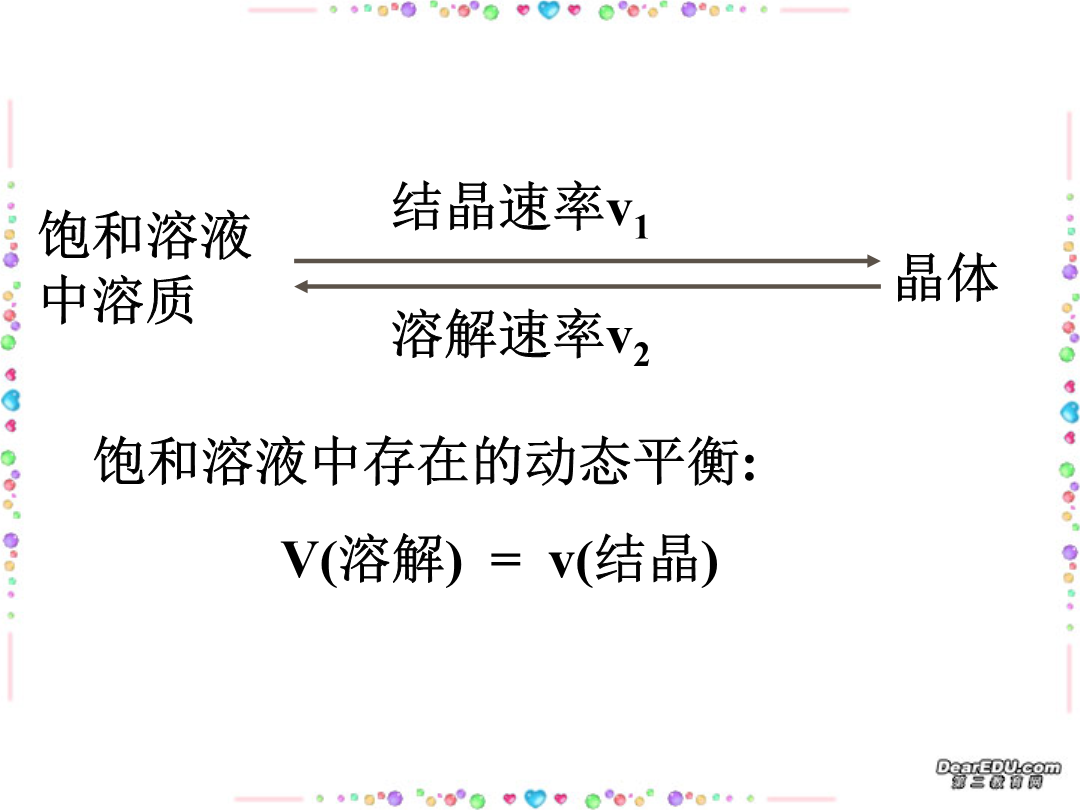
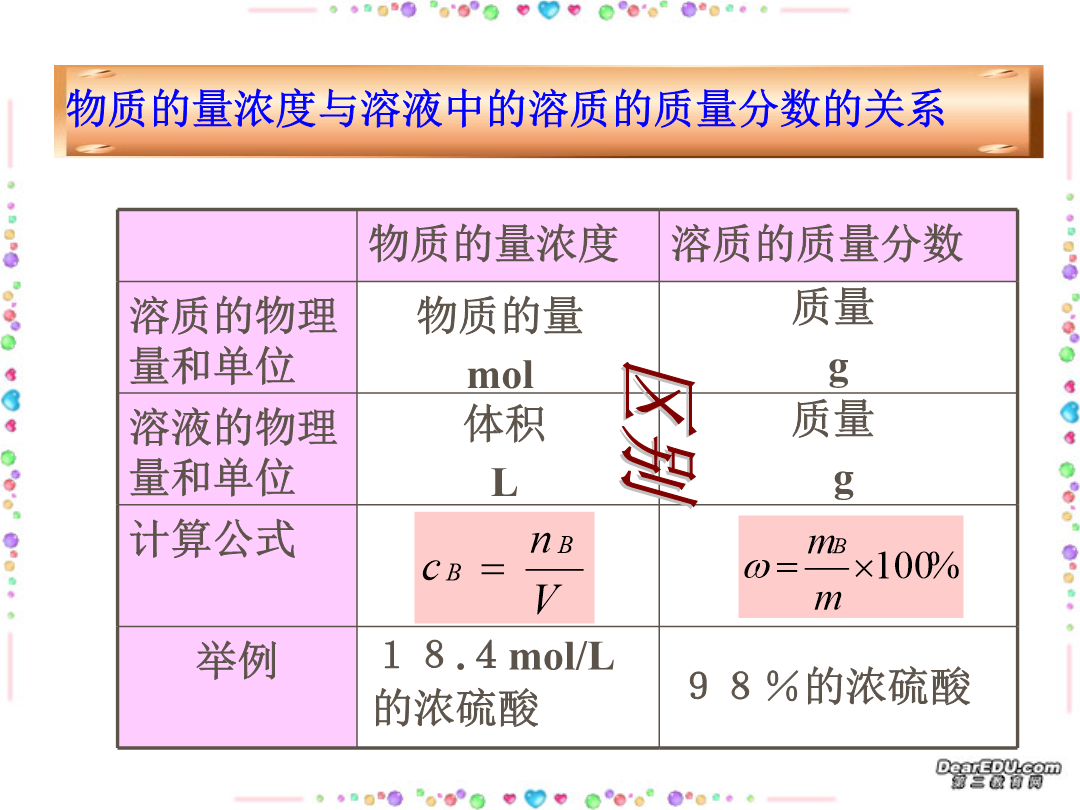
溶液浓度的有关计算物质的量浓度溶质+溶剂饱和溶液中溶质练习:向一定温度下足量饱和硫酸铜溶液中加入wg硫酸铜粉末,搅拌后静置.下列说法正确的是()A.硫酸铜不溶解,其浓度不变B.硫酸铜可溶解,并达到溶解平衡,其质量不变C.溶液的浓度不变D.溶液的质量不变E.溶液的质量减少F.硫酸铜变为CuSO4·5H2O,其质量为(W×250/160)gF.硫酸铜变为CuSO4·5H2O,其质量大于(W×250/160)g饱和溶液练习:现有50g50﹪的CuSO4溶液,要使其浓度增大一倍,可采用的方法有:(1)可将原溶液蒸

溶液浓度的有关计算 新课标 人教版.rar
溶液浓度的有关计算物质的量浓度溶质+溶剂饱和溶液中溶质练习:向一定温度下足量饱和硫酸铜溶液中加入wg硫酸铜粉末,搅拌后静置.下列说法正确的是()A.硫酸铜不溶解,其浓度不变B.硫酸铜可溶解,并达到溶解平衡,其质量不变C.溶液的浓度不变D.溶液的质量不变E.溶液的质量减少F.硫酸铜变为CuSO4·5H2O,其质量为(W×250/160)gF.硫酸铜变为CuSO4·5H2O,其质量大于(W×250/160)g饱和溶液练习:现有50g50﹪的CuSO4溶液,要使其浓度增大一倍,可采用的方法有:(1)可将原溶液蒸

课件-全国-2006_一定物质的量浓度溶液的配制课件 新课标 人教版.rar
一定物质的量浓度溶液的配制三、配制一定物质的量浓度的溶液配制100mL1mol/LCuSO4溶液,下列方法正确的是()容量瓶的使用1、计算2、称量4.转移——要用玻璃棒引流实验仪器:问题与讨论:1.为什么要用蒸馏水洗涤烧杯内壁?2.为什么要将洗涤后的溶液注入到容量瓶中?3.为什么不直接在容量瓶中溶解固体?4.玻璃棒的作用是什么?5.为什么要轻轻振荡容量瓶,使容量瓶中的溶液充分混合?1.称量时,物体与砝码的位置颠倒。5.溶质溶解后,没有恢复至室温即转移。

溶液浓度的有关计算 新课标 人教.ppt
溶液浓度的有关计算物质的量浓度溶质+溶剂饱和溶液中溶质练习:向一定温度下足量饱和硫酸铜溶液中加入wg硫酸铜粉末搅拌后静置.下列说法正确的是()A.硫酸铜不溶解其浓度不变B.硫酸铜可溶解并达到溶解平衡其质量不变C.溶液的浓度不变D.溶液的质量不变E.溶液的质量减少F.硫酸铜变为CuSO4·5H2O其质量为(W×250/160)gF.硫酸铜变为CuSO4·5H2O其质量大于(W×250/160)g饱和溶液练习:现有50g50﹪的CuS

课件-全国-2006_新课标 人教版初三化学溶液的形成.rar
溶液的形成食盐一、溶液一、溶液一、溶液1.溶液是无色的液体。2.冰水混合体是溶液。3.把食盐溶液倒掉一半后,变稀了。4.在温度不变,水不蒸发的条件下,蔗糖溶液中的蔗糖会从水中分离出来。一、溶液溶液、溶剂的判断:溶液洗涤剂具有乳化的功能,它能使植物油分散成无数细小的液滴,而不聚集成大的油珠。这些细小的液滴能随着水流走,所以衣服、餐具上的油污可以用加入洗涤剂的水洗掉。乳浊液你知道便携式无电冰箱、冰桶、冰杯吗?便携式无电冰箱、冰桶、冰杯及制冷剂无电冰箱由壳体、夹层胆、箱门、冷藏室及冷冻室构成。无电冰桶
