
课件-全国-2010_高中化学无机化学竞赛辅导课件.rar

康佳****文库








亲,该文档总共46页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

课件-全国-2010_高中化学无机化学竞赛辅导课件.rar
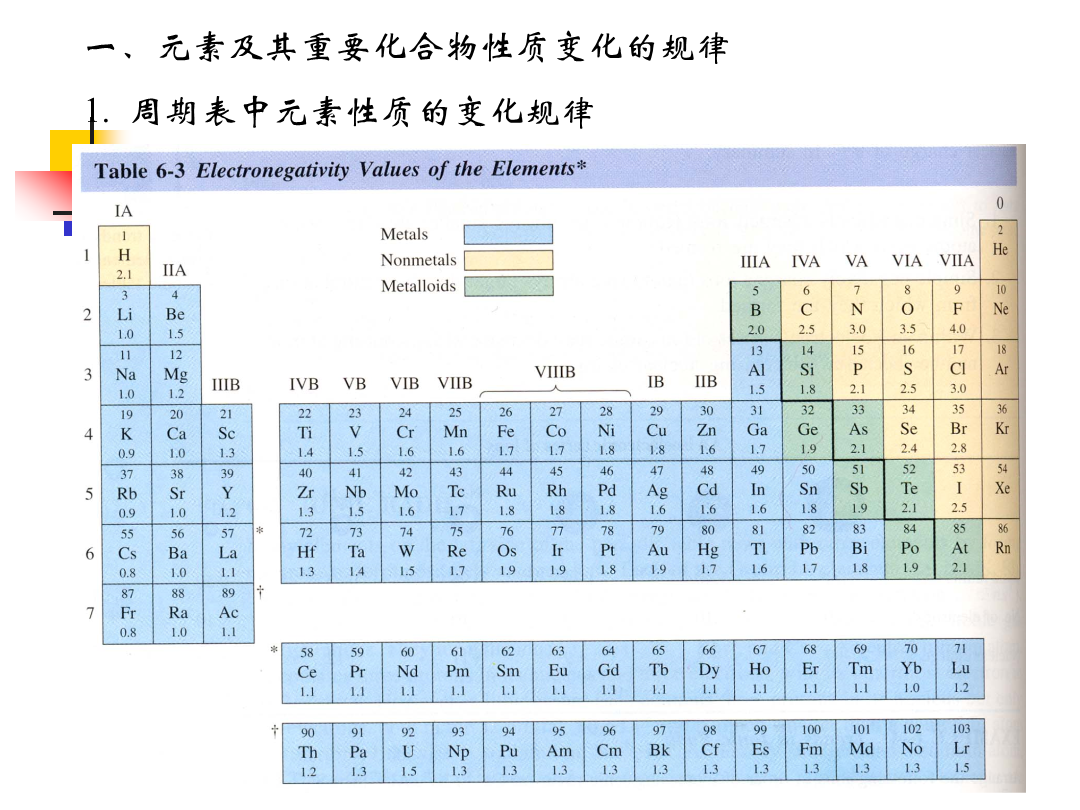
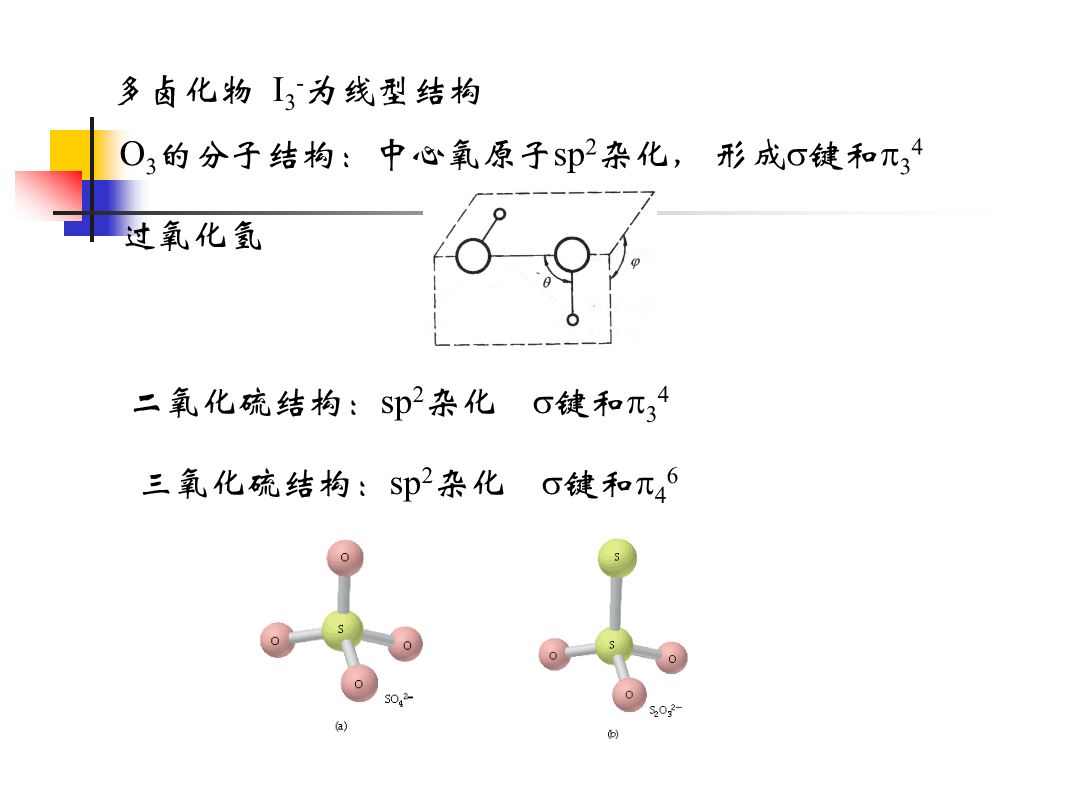
元素部分一、元素及其重要化合物性质变化的规律1.周期表中元素性质的变化规律主族元素化合物性质的变化规律s区金属氢氧化物的碱性强弱p区元素的氧化物、氢氧化物及含氧酸酸碱性的变化规律3)p区元素最高氧化态水和氧化物的氧化性强弱的变化规律4)p区元素氢化物的酸性和氧化性的变化规律3.副族元素化合物性质的变化规律---酸碱性及氧化还原性二、重要化合物和离子的结构多卤化物I3-为线型结构氮分子的结构含硼化合物的结构三、重要化合物和离子的化学性质1.氧化还原性质过氧化氢的氧化还原性质硝酸与金属的反应:a)FeCrAl

高中化学无机化学竞赛辅导课件.ppt
元素部分一、元素及其重要化合物性质变化的规律1.周期表中元素性质的变化规律主族元素化合物性质的变化规律s区金属氢氧化物的碱性强弱p区元素的氧化物、氢氧化物及含氧酸酸碱性的变化规律3)p区元素最高氧化态水和氧化物的氧化性强弱的变化规律4)p区元素氢化物的酸性和氧化性的变化规律3.副族元素化合物性质的变化规律---酸碱性及氧化还原性二、重要化合物和离子的结构多卤化物I3-为线型结构氮分子的结构含硼化合物的结构三、重要化合物和离子的化学性质1.氧化还原性质过氧化氢的氧

课件-全国-2010_高中化学 卤素竞赛课件.rar
第十二章卤素金属、非金属、惰气特点:①第一排元素特别:r小、轨道数少、电负性大。例:电子亲和能F<Cl(但电负性F>Cl);CCl4稳定,SiCl4易水解。②从上到下金属性增强,正低价趋稳。相反,非金属性增强,正高价趋稳其中因为有惰性电子对6s2(5s2)不易失去,而取正低价。Tl+1Pb+2Bi+3稳定而C、Si+4;N、P+5;S+6;Cl+5,+7稳定③第四周期与第三周期相比递变反常:表现更不易失电子。例:AsCl5不存在,而有PCl5;Se-SHClO4-Cl2=1.19HBrO4-Br2

课件-全国-2010_高中化学 物质状态竞赛课件.rar
第二章物质状态pv=nRT各物理量的单位:1-3例题P4n=[PV]/[RT]=[101325*30.00]/[8.314*293.15]=12.47mol二:分压定律一个容器内有几种混合气体,相互间不发生化学反应的条件下,总压强P总与各种气体的分压Pi之间有如下关系:P总=P1+P2+P3+...+Pn对于理想气体,容易得证:n总=n1+n2+n3+....+nn左边:P总=n总RT/V右边=n1*RT/V+n2*RT/V+...+nn*RT/V=[n1+n2+...+nn]*RT/V=n总*RT/V=

课件-全国-2010_高中化学 配合物竞赛课件.rar
配位化学基础知识第一节配位化学基础知识§1-1配位化学的历史及有关术语络合物,complex一.配合物定义:广义的定义(IUPAC):凡原子B或原子团C与原子A结合而成的分子或离子。二、配合物的组成及其有关术语:按成键方式分类按配位原子数目分类异性双位配体(两可配体):桥连配体:影响配位数的因素:§1-2配合物的类型双核配合物§1-3配合物的命名例1:[Fe(CN)6]4-二、配体的次序:练习:[Cu(acac)(bpy)(py)]+三、含配阴离子的配合物:六、键合异构体的命名②在配体名称后写出配位原子的
