
【精编医学资料】制药工艺用水系统的验证.ppt

骊蓉****23









亲,该文档总共76页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

【精编医学资料】制药工艺用水验证.pptx
制药工艺用水的设计、验证、运行和维护微生物限度举例(2005版药典)产品所需的工艺用水要求的选择源水水质水处理系统的各项技术选择一。概述1、制药工艺用水的定义〔2005版药典〕1.1中国药典2005版中注射用水与纯化水的主要区别1.2纯化水和注射用水2005年版1.3中国药典2005版、欧洲药典、美国药典版关于纯化水的标准1.4制药工艺用水的定义〔美国药典31版〕2、各种工艺用水的用途(98版GMP/2005药典)〔1〕2、各种工艺用水的用途(98版GMP/2005药典)〔2〕注射用水:无菌

【精编医学资料】制药工艺用水系统的验证.ppt
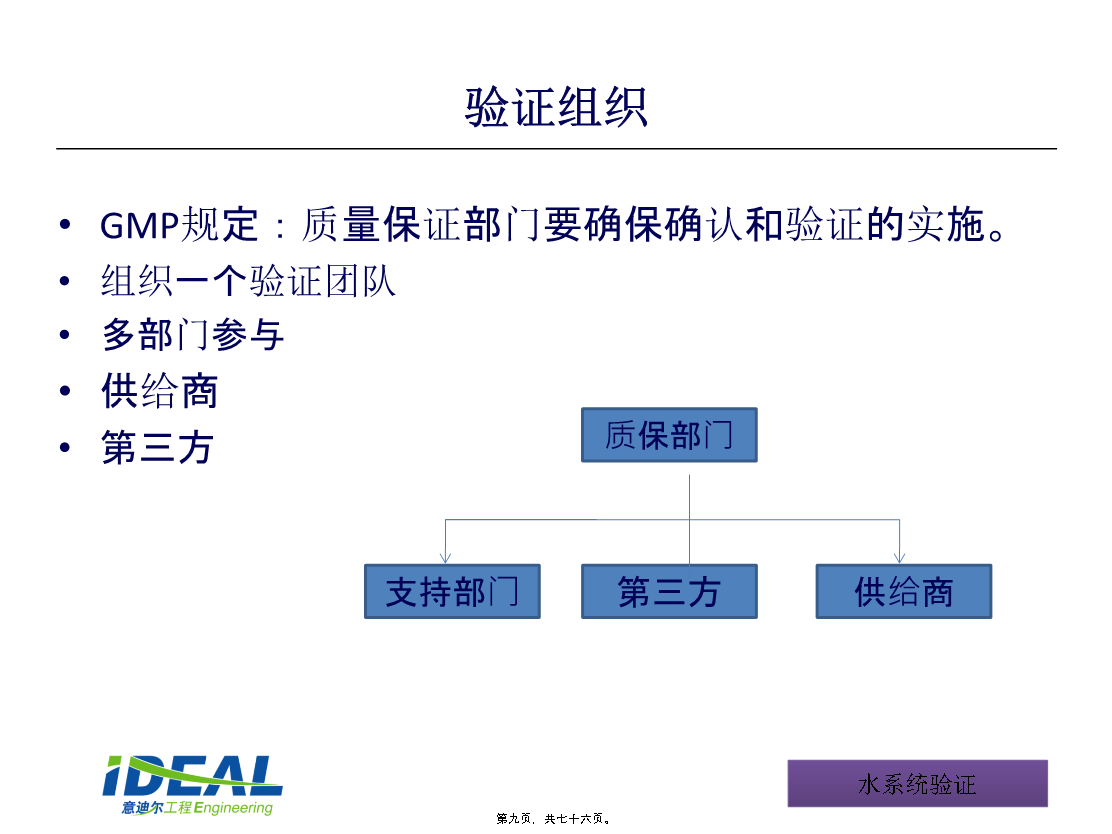
上海意迪尔洁净系统工程有限责任公司内容提要第一局部验证-以始为终验证方案验证方案的法规要求验证范围验证目标验证组织验证执行可追溯性可持续性第二局部工艺用水的定义和标准-纯化水(PW)工艺用水的定义和标准-注射用水〔WFI〕设计流程用户需求标准URS功能设计标准详细设计标准关键质量属性CQA微生物控制警戒和行动水平关键运行参数COP关键工艺参数—WFI分配回水流速关键工艺参数—WFI分配运行温度工艺用水系统的验证-设计确认DQ系统影响评价和风险评估风险评估流程系统影响评价分配系统界限分配

最新精编医学专题—制药工艺用水系统的验证.pptx
上海意迪尔洁净(jiéjìng)系统工程有限公司内容提要(nèirónɡtíyào)第一(dìyī)部分验证(yànzhèng)-以始为终验证(yànzhèng)计划验证计划(jìhuà)的法规要求验证(yànzhèng)范围验证(yànzhèng)目标验证(yànzhèng)组织验证(yànzhèng)执行可追溯性可持续性第二(dìèr)部分工艺(gōngyì)用水的定义和标准-纯化水(PW)工艺用水的定义和标准(biāozhǔn)-注射用水(WFI)设计(shèjì)流程用户需求(xūq

最新精编医学专题—制药工艺用水验证.ppt
制药工艺(gōngyì)用水的设计、验证、运行和维护微生物限度(xiàndù)举例(2005版药典)产品所需的工艺(gōngyì)用水要求的选择源水水质水处理系统的各项技术选择一。概述(ɡàishù)1、制药工艺用水的定义(dìngyì)(2005版药典)1.1中国药典(yàodiǎn)2005版中注射用水与纯化水的主要区别1.2纯化(chúnhuà)水和注射用水2005年版1.3中国药典2005版、欧洲药典、美国药典版关于(guānyú)纯化水的标准1.4制药工艺用水的定义(美国(měi

医学专题—制药工艺用水系统的验证.pptx
上海意迪尔洁净(jiéjìng)系统工程有限公司内容提要(nèirónɡtíyào)第一(dìyī)部分验证(yànzhèng)-以始为终验证(yànzhèng)计划验证计划(jìhuà)的法规要求验证(yànzhèng)范围验证(yànzhèng)目标验证(yànzhèng)组织验证(yànzhèng)执行可追溯性可持续性第二(dìèr)部分工艺(gōngyì)用水的定义和标准-纯化水(PW)工艺用水的定义和标准(biāozhǔn)-注射用水(WFI)设计(shèjì)流程用户需求(xūqiú)标准UR
