
催化原理吸附作用.ppt

YY****。。








亲,该文档总共105页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

催化原理吸附作用.ppt
第二章吸附作用吸附作用参考书:一、概述吸附吸/脱附(Adsorption)吸附和脱附的定义什么是表面?GerhardErtl,TheNobelPrizeinChemistry2007Fritz-Haber-InstitutderMax-Planck-Gesellschaft,Berlin,Germany1、晶体七大晶系晶体缺陷晶体缺陷点缺陷SchottkydefectsFrenkeldefectsExtrinsicdefects线缺陷Burger回路线缺陷面缺陷电子缺陷Al2O32.晶面与晶面指数低密勒指

吸附作用与多相催化要点.ppt
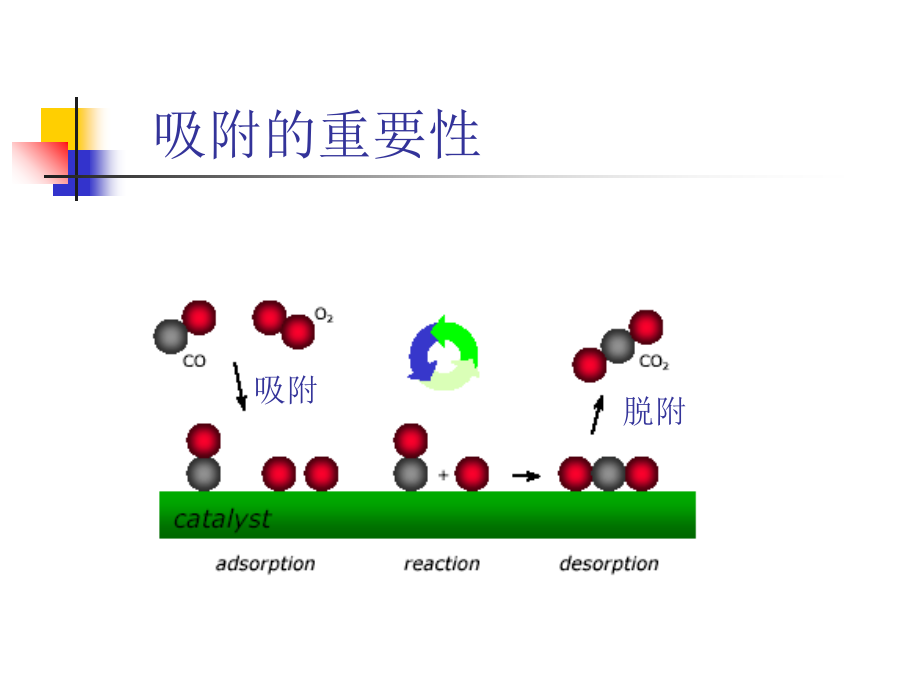
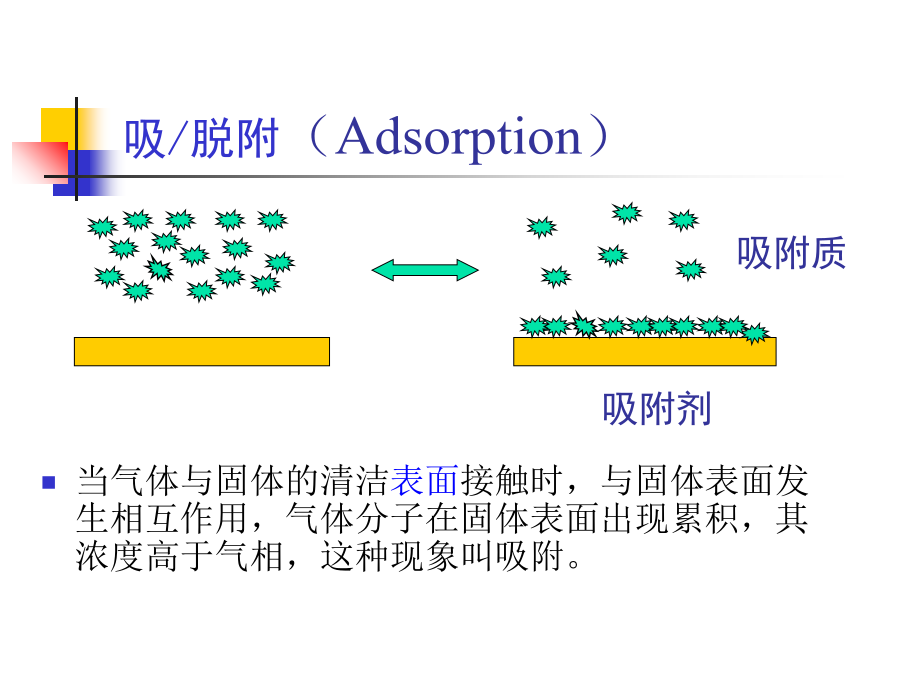
第二章催化剂中的吸附作用反应物分子从气流主体扩散到催化剂外表面(外扩散);②反应物分子从催化剂外表面扩散到内表面(内扩散);③反应物分子在催化剂表面吸附(吸附过程);④吸附反应物转化成产物(表面反应);⑤产物自催化剂表面或内表面的脱附(脱附过程);⑥脱附的产物分子从微孔扩散到催化剂外表面(内扩散);⑦产物分子从外表面扩散到主气流中(外扩散)。2.1几个概念吸附:气体或液体在固体表面层富集。吸附质(absorbate):被吸附的物质。吸附剂(absorbent):吸附别的物质的固体。晶体由空间排列很有规律的

吸附作用和多相催化tl.ppt
多相催化的反应步骤一、五个基本步骤:外扩散和内扩散第一节多相催化的基本原理多相催化反应的化学过程二、反应物分子的化学吸附物理吸附与化学吸附区别物理吸附是表面质点和吸附分子之间的分子力而引起的。具体地是由永久偶极、诱导偶极、色散力等三种范德华引力。物理吸附就好像蒸汽的液化只是液化发生在固体表面上罢了。分子在发生物理吸附后分子没有发生显著变化。化学吸附是在催化剂表面质点吸附分子间的化学作用力而引起的,如同化学反应一样,而两者之间发生电子转移并形成离子型,共价型,自由基型,络合型等新的化学键。吸附分子往往会解离

吸附作用与多相催化要点学习资料.pptx
会计学反应物分子从气流主体扩散到催化剂外表面(外扩散);②反应物分子从催化剂外表面扩散到内表面(内扩散);③反应物分子在催化剂表面吸附(吸附过程);④吸附反应物转化成产物(表面反应);⑤产物自催化剂表面或内表面的脱附(脱附过程);⑥脱附的产物分子从微孔扩散到催化剂外表面(内扩散);⑦产物分子从外表面扩散到主气流中(外扩散)。2.1几个概念吸附:气体或液体在固体表面层富集。吸附质(absorbate):被吸附的物质。吸附剂(absorbent):吸附别的物质的固体。2.2.1晶体由空间排列很有规律的微粒(原

工业催化-第二章 吸附作用与多相催化001.ppt
第二章吸附作用与多相催化催化研究的三个层面多相催化反应步骤扩散与多相催化反应扩散的类型外扩散内扩散扩散控制外扩散阻滞效应的判断内扩散阻滞效应的判断效率因子(i)效率因子的分析吸附与多相催化反应固体表面的吸附共价键型固体的表面作用力离子键型固体的表面作用力固体表面的特性固体表面吸附现象的本质固体表面的气体与液体具有在固体表面自动聚集,以求降低表面能的趋势。当气体或蒸汽在固体表面被吸附时,固体称为吸附剂,被吸附的气体称为吸附质。(2)吸附平衡(4)吸附曲线吸附作用几个基本概念吸附作用几个关键概念物理吸附与化
