
配位化合物.ppt

一吃****继勇







亲,该文档总共84页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

配位化合物配位化合物的概述.ppt
第二节EDTA及其配位特性二、EDTA配位反应的特点第三节配位反应的副反应及条件稳定常数一、配位剂EDTA的副反应和反应系数(二)EDTA共存离子效应与共存离子效应系数二、金属离子的副反应和副反应系数(二)金属离子的水解效应与水解效应系数M(四)条件稳定常数第四节配位滴定的基本原理例:二、影响突跃范围的因素三、配位滴定准确性的判断四、单一金属离子滴定适宜的酸度第五节金属指示剂二、指示剂具备的条件第七节EDTA标准溶液的配制第八节配位滴定方式第九节配位滴定在医学中的应用----硬水的滴定二、Ca2+,Mg2

配位化合物与配位平衡.pptx
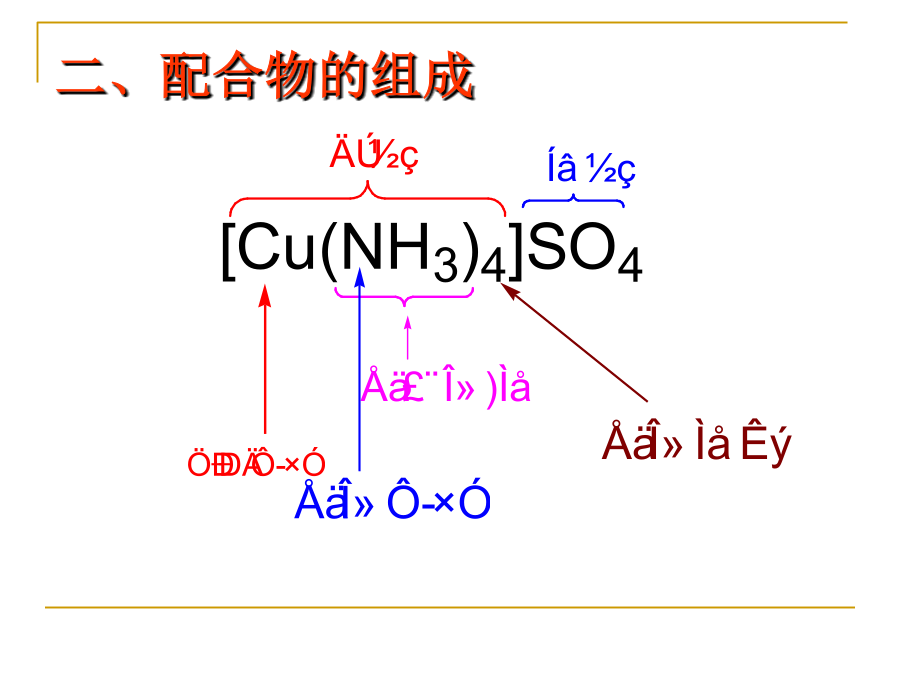
第二单元课题4一配位化合物一配位化合物一配位化合物eg:[Cu(H2O)4]2+eg:H[AuCl4]2配位分子不带电荷的电中性配位化合物。[CoCl3(NH3)3]、[Ni(CO)4]、[Fe(CO)5]等。3配位化合物含有配离子的化合物以及中性配位分子统称为配位化合物,简称配合物。[KAl(SO4)2.12H2O]是复盐而不是配位化合物(二)配位化合物的组成1内界在配合物化学式中用方括号表示内界。配合物的内界能稳定地存在于晶体及水溶液中。它是配合物的特征部分,由中心离子与配体结合而成,它的结构和性质与

配位化合物与配位平衡.ppt
第七章配位化合物与配位平衡7.1配合物与螯合物7.2配位平衡及其影响因素7.3配位滴定法7.1配合物与螯合物配离子(Complexion):由配位键结合而成,如Cu(NH3)42+,配合物与复盐的区别:配合物含有配合键。复盐溶于水后均为简单离子,无复杂离子,如明矾KAl(SO4)2·12H2O。阳离子d区、ds区中性原子Fe(CO)5p区的某些金属离子Sn2+、Pb2+、Bi3+等极少数高价非金属Si(Ⅵ)、B(Ⅲ)与中心离子(或原子)以配位键结合的原子提供电子对。N,O,Cl,F,S…表7.1常见的配体

配位化合物与配位平衡.pptx
1、日常生活中:蓝墨水渍、铁锈,可以用草酸洗去,原因在于草酸与Fe3+形成了Fe(C2O4)33-配合物;2、定影剂2S2O32-+AgBrAg(S2O3)23-;3、叶绿素为Mg的配合物;4、与生命有关的:人体中输氧的血红素―铁配合物;起血凝作用的为钙的配合物;5、已证实多种顺铂([PtCl2(NH3)2])及其一些类似物对子宫癌、肺癌有明显疗效。1.熟悉配位化合物的基本概念、组成和命名;1相关的定义和命名组成为CoCl3·6NH3的化合物第一次制备出时,人们认为它是由两个简单化合物(CoCl3和NH

配位化合物和配位平衡.pptx
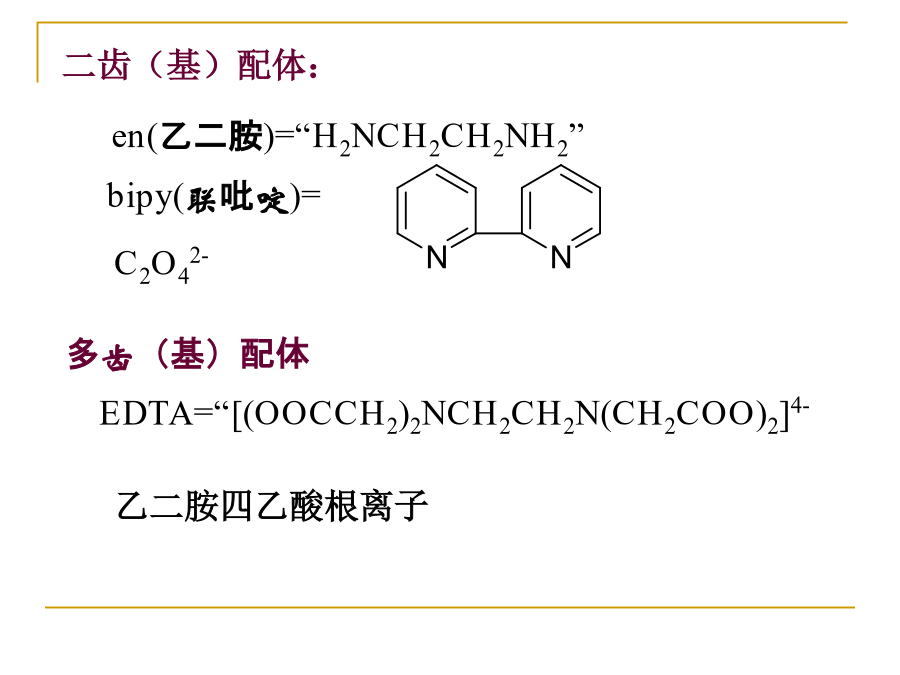
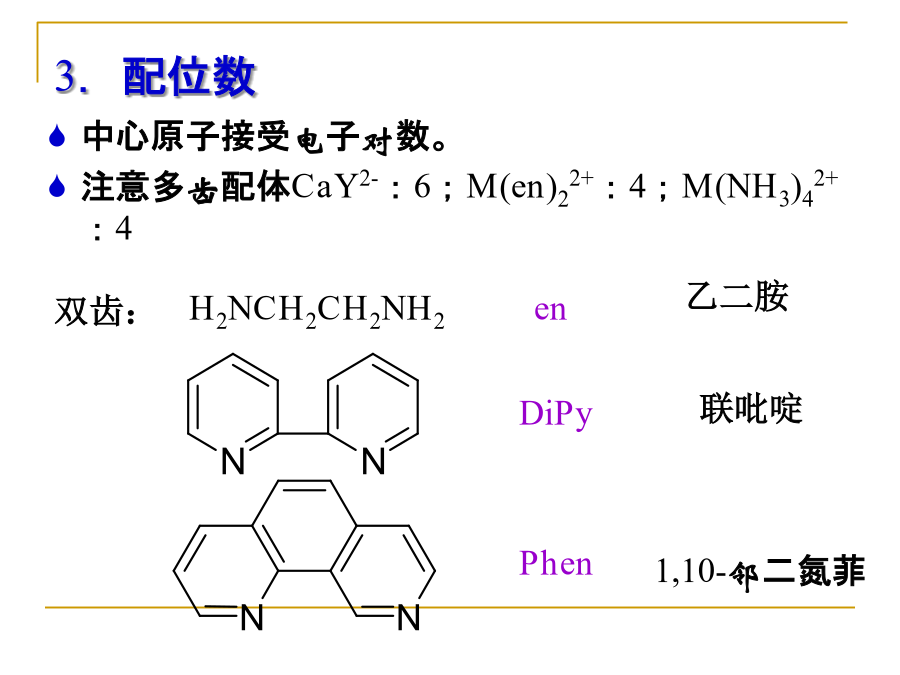
10.1配位化合物(配合物)的组成第10章配位化合物(8h)内界:中心离子(中心形成体)——具有空轨道的离子(1)一般是过渡金属阳离子,如:Fe2+、Co3+(2)少数非过渡金属离子,如:Ca2+、Al3+(3)也可是中性原子,如:Ni(CO)4中的Ni等(4)少数负氧化态的离子,如:I3-中的I,H[Co(CO)4]中的Co均为-1价(5)少数高氧化态的非金属元素,如:[SiF6]2-、[PF6]-、[BF4]-中Si、P、B配位原子——配体中具有孤对电子,直接与中心原子相连的原子,如:N等,一般是ⅣA
