
冲刺高考化学二轮复习 核心考点特色突破 突破37 滴定曲线及应用(含解析)-人教版高三全册化学试题.doc

小寄****淑k










亲,该文档总共16页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

冲刺高考化学二轮复习 核心考点特色突破 突破37 滴定曲线及应用(含解析)-人教版高三全册化学试题.doc
突破37滴定曲线及应用【突破必备】酸碱中和滴定曲线氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线曲线起点不同:强碱滴定强酸、弱酸的曲线强酸起点低;强酸滴定强碱、弱碱的曲线强碱起点高突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)室温下pH=7不一定是终点:强碱与强酸反应时终点是pH=7;强碱与弱酸(强酸与弱碱)反应时终点不是pH=7(强碱与弱酸反应终点是pH>7强酸与弱碱反应终点是pH<7)2.巧抓“

冲刺高考化学二轮复习 核心考点特色突破 突破37 滴定曲线及应用(含解析)-人教版高三全册化学试题.doc
突破37滴定曲线及应用【突破必备】酸碱中和滴定曲线氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)室温下pH=7不一定是终点:强碱与强酸反应时,终点是pH=7;强碱与弱酸(强酸与弱碱)反应时,终点不是pH=7(强碱与弱酸反应终点是pH>7,强酸与弱碱反应终点是pH<7)2.

冲刺高考化学二轮复习 核心考点特色突破 突破32 电解原理及应用(含解析)-人教版高三全册化学试题.doc
突破32电解原理及应用【突破必备】1.“五类”依据判断电解池电极判断依据电极电极材料电极反应电子流向离子移向电极现象阳极与电源正极相连氧化反应流出阴离子移向电极溶解或pH减小阴极与电源负极相连还原反应流入阳离子移向电极增重或pH增大2.电解池电极反应式的书写模式:3.有关电化学计算的三大方法(1)根据电子守恒计算用于串联电路中电解池阴阳两极产物、原电池正负两极产物、通过的电量等类型的计算,其依据是电路中转移的电子数相等。(2)根据总反应式计算先写出电极反应式,再写出总反应式,最后根据总反应式列出比例式计算

冲刺高考化学二轮复习 核心考点特色突破 突破32 电解原理及应用(含解析)-人教版高三全册化学试题.doc
突破32电解原理及应用【突破必备】1.“五类”依据判断电解池电极判断依据电极电极材料电极反应电子流向离子移向电极现象阳极与电源正极相连氧化反应流出阴离子移向电极溶解或pH减小阴极与电源负极相连还原反应流入阳离子移向电极增重或pH增大2.电解池电极反应式的书写模式:3.有关电化学计算的三大方法(1)根据电子守恒计算用于串联电路中电解池阴阳两极产物、原电池正负两极产物、通过的电量等类型的计算其依据是电路中转移的电子数相等。(2)根据总反应式计算先写出电极反应式再写出总反应式最后根据总反应式列出比例式计算。(
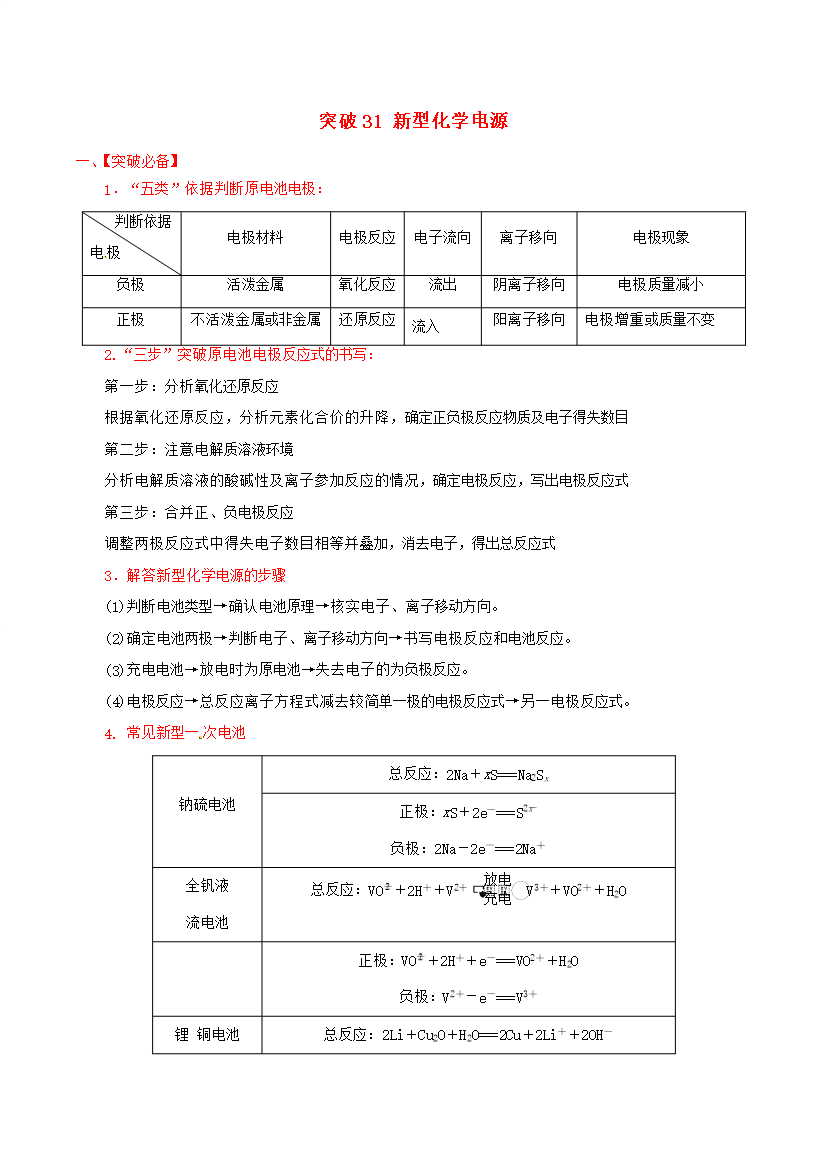
冲刺高考化学二轮复习 核心考点特色突破 突破31 新型化学电源(含解析)-人教版高三全册化学试题.doc
突破31新型化学电源【突破必备】1.“五类”依据判断原电池电极:判断依据电极电极材料电极反应电子流向离子移向电极现象负极活泼金属氧化反应流出阴离子移向电极质量减小正极不活泼金属或非金属还原反应流入阳离子移向电极增重或质量不变2.“三步”突破原电池电极反应式的书写:第一步:分析氧化还原反应根据氧化还原反应分析元素化合价的升降确定正负极反应物质及电子得失数目第二步:注意电解质溶液环境分析电解质溶液的酸碱性及离子参加反应的情况确定电极反应写出电极反应式第三步:合并正、负电极反应调整两极反应式中得失电子数目相等
