
(通用版)高考化学二轮复习 题型三 化学反应原理综合题的研究逐空突破课件-人教版高三全册化学课件精编.pptx

xf****65







亲,该文档总共85页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

(通用版)高考化学二轮复习 题型三 化学反应原理综合题的研究逐空突破课件-人教版高三全册化学课件精编.pptx
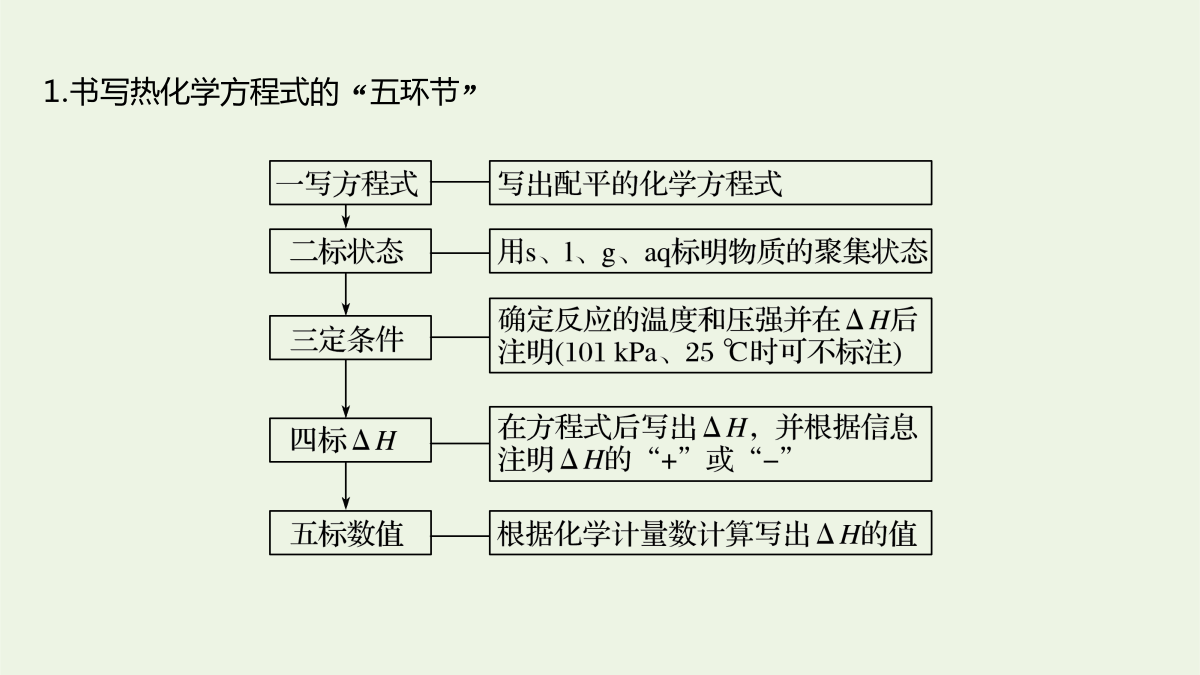
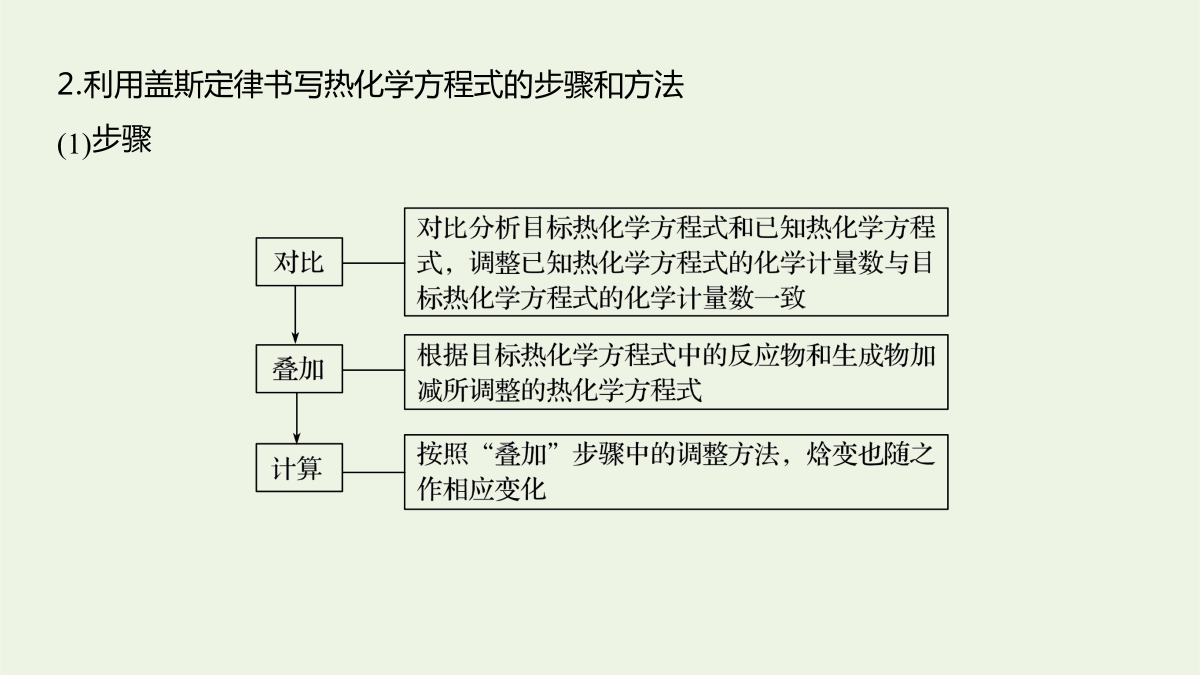
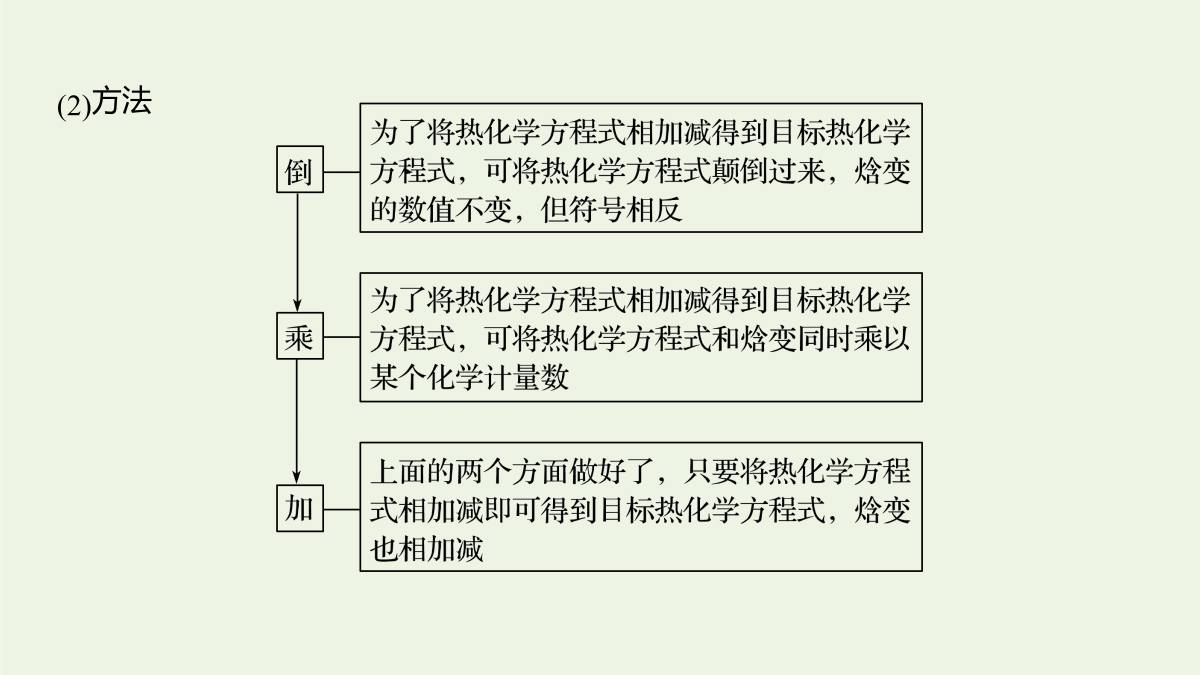
2逐空突破打造“精品组件”常考题空1热化学方程式及反应热的计算常考题空1热化学方程式及反应热的计算1.书写热化学方程式的“五环节”2.利用盖斯定律书写热化学方程式的步骤和方法(1)步骤(2)方法题组一热化学方程式的书写1.依据反应事实书写有关热化学方程式:(1)[2017·天津,7(3)]0.1molCl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为____________________________________

(通用版)高考化学二轮复习 题型三 化学反应原理综合题的研究逐空突破课件-人教版高三全册化学课件.pptx
2逐空突破打造“精品组件”常考题空1热化学方程式及反应热的计算常考题空1热化学方程式及反应热的计算1.书写热化学方程式的“五环节”2.利用盖斯定律书写热化学方程式的步骤和方法(1)步骤(2)方法题组一热化学方程式的书写1.依据反应事实书写有关热化学方程式:(1)[2017·天津7(3)]0.1molCl2与焦炭、TiO2完全反应生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物放热4.28kJ该反应的热化学方程式为________________________________

(通用版)高考化学二轮复习 题型三 化学反应原理综合题的研究逐空突破课件-人教版高三全册化学课件.pptx
2逐空突破打造“精品组件”常考题空1热化学方程式及反应热的计算常考题空1热化学方程式及反应热的计算1.书写热化学方程式的“五环节”2.利用盖斯定律书写热化学方程式的步骤和方法(1)步骤(2)方法题组一热化学方程式的书写1.依据反应事实书写有关热化学方程式:(1)[2017·天津7(3)]0.1molCl2与焦炭、TiO2完全反应生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物放热4.28kJ该反应的热化学方程式为________________________________

(通用版)高考化学二轮复习 题型一 化学实验综合题的研究逐空突破课件-人教版高三全册化学课件精编.pptx
2逐空突破打造“精品组件”常考题空1常考仪器的辨认、选择与连接常考题空1常考仪器的辨认、选择与连接(2019·齐齐哈尔一模改编)实验室从废定影液[含Ag(S2O3)和Br-等]中回收Ag和Br2可能用到的装置如下图:主要实验步骤如下,回答下列问题:(1)向废定影液中加入Na2S溶液沉淀银离子,分离Ag2S时,选用的装置是_____(填装置序号,下同)。(2)灼烧Ag2S制取金属Ag,用到的实验装置是______。(3)制取Cl2并将Cl2通入滤液中氧化Br-,获取Br2,制取氯气的实验装置是_______
(通用版)高考化学二轮复习 题型二 无机综合——化工流程综合题的研究逐空突破课件-人教版高三全册化学课件.pptx
2逐空突破打造“精品组件”常考题空1化学式、电子式等化学用语的规范书写常考题空1化学式、电子式等化学用语的规范书写1.化合价体现化合物中不同元素原子或离子的个数比关系的数值。(1)在离子化合物中化合价的数值就是一个原子得失电子的数目失电子的原子为正化合价得电子的原子为负化合价。(2)在共价化合物中化合价的数值就是一个原子跟其他元素原子形成共用电子对的数目电子对偏离的原子为正价电子对偏向的原子为负价。如:分析(1)Na2O2(2)N2H4中各元素的化合价。分析(1)在Na2O2中Na失去一个电子则
