
第三章-蛋白质的通性、纯化与表征.ppt

zh****db









亲,该文档总共32页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

第三章-蛋白质的通性、纯化与表征.ppt
第三章蛋白质的通性、纯化与表征蛋白质与多肽一样,能够发生两性离解,也有等电点。在等电点时,蛋白质的溶解度最小,在电场中不移动。在不同的pH环境下,蛋白质的电学性质不同。在等电点偏酸性溶液中,蛋白质粒子带正电荷,在电场中向负极移动;在等电点偏碱性溶液中,蛋白质粒子带负电荷,在电场中向正极移动。这种现象称为蛋白质电泳P蛋白质分子的颗粒直径已达1-100nm,处于胶体颗粒的范围。因此,蛋白质具有亲水溶胶的性质。由于胶体溶液中的蛋白质不能通过半透膜,因此可以应用透析法将非蛋白的小分子杂质除去。蛋白质的胶体性质蛋白

蛋白质的通性纯化和表征.pptx
蛋白质的通性纯化和表征一.蛋白质酸碱性质各个解离基团pK值与游离氨基酸不完全相同。短肽等电点和净电荷量能够依据pK值计算,蛋白质等电点要用等电聚焦等方法测定。二.蛋白质分子大小与形状(一)依据化学组成测定最低相对分子质量假定某种微量成份只有一个,测出其百分含量后,可用百分比式算出最低相对分子质量。若测出两种微量成份百分含量,分别用百分比式算出最低相对分子质量不相同时,可计算两个最低相对分子质量近似最小公倍数。例题:一个纯酶含亮氨酸(Mr131)1.65%,含异亮氨酸(Mr131)2.48%,求最低相对分子

第03章 蛋白质的通性、纯化与表征.ppt
蛋白质是一种两性电解质蛋白质份子表面分布着不同的电荷。蛋白质等电点:使某特定蛋白质分子上所带正负电荷相等时溶液的pH值为蛋白质的等电点(pI)。蛋白质的等电点和它所含的酸性氨基酸残基和碱性氨基酸残基的比例有关。由于①蛋白质表面极性基团形成的水化膜,②非等电状态时,同种电荷的互相排斥,③质点大小在1-100nm,故蛋白质水溶液是胶体溶液。蛋白质沉淀(precipitation)的方法④生物碱试剂和某些酸类沉淀法:pH小于等电点时,蛋白质带正电荷,易与生物碱试剂和酸类的负离子生成不溶性沉淀。生物碱试剂:是指能

第3章 蛋白质的通性、纯化和表征.ppt
第3章蛋白质的通性、纯化和表征一、蛋白质的酸碱性质和等电点二、蛋白质的胶体性质与蛋白质的沉淀2、沉淀蛋白质的方法①盐析法:大量的中性盐((NH4)2SO4、Na2SO4、NaCl),使蛋白质脱去水化层而聚集沉淀;不引起变性。②有机溶剂沉淀法:破坏水化膜,降低介电常数,丙酮、乙醇等;③重金属盐沉淀法:pH>pI时,蛋白质颗粒带负电荷,与重金属离子(Hg2+.Pb2+.Cu2+等)结成不溶性沉淀;④生物碱试剂和某些酸类沉淀法:pH小于pI时,蛋白质带正电荷,易与生物碱试剂和酸类的负离子生成不溶性沉淀。生物碱试

蛋白质分分离纯化和表征.ppt
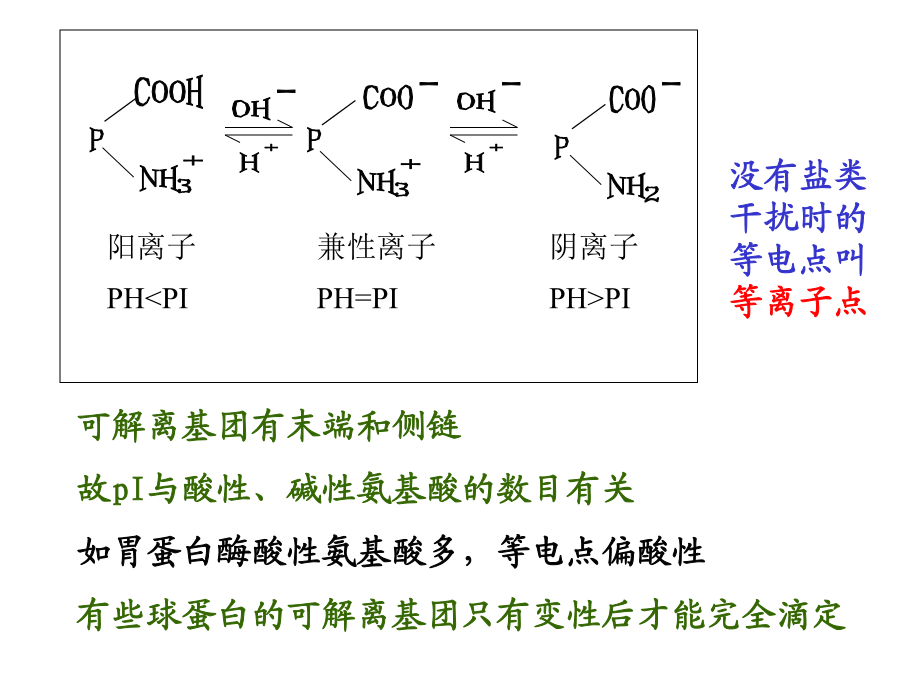
等电点(pI):在特定pH条件下,某种蛋白质分子所带正负电荷相等,静电荷为零,这一pH称为该蛋白质的等电点(pI)。等电pH并不是一个恒定的值,它会因溶液中盐的种类和离子强度的影响而有所不同。等离子点(isoionicpiont):蛋白质在纯水溶液中的带电状态则没有其他离子干扰,完全由H+的解离和结合来决定,这种条件下的等电点称为等离子点。等离子点是蛋白质的特征性常数。二、蛋白质的分子大小与分子量的测定(一)根据化学组成测定最低相对分子量用化学分析方法测出蛋白质中某一微量元素的含量。并假设蛋白质分子中含有
