
氟喹诺酮药物的合成技术ppt课件.ppt

你的****书屋





亲,该文档总共102页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

氟喹诺酮药物的合成技术ppt课件.ppt
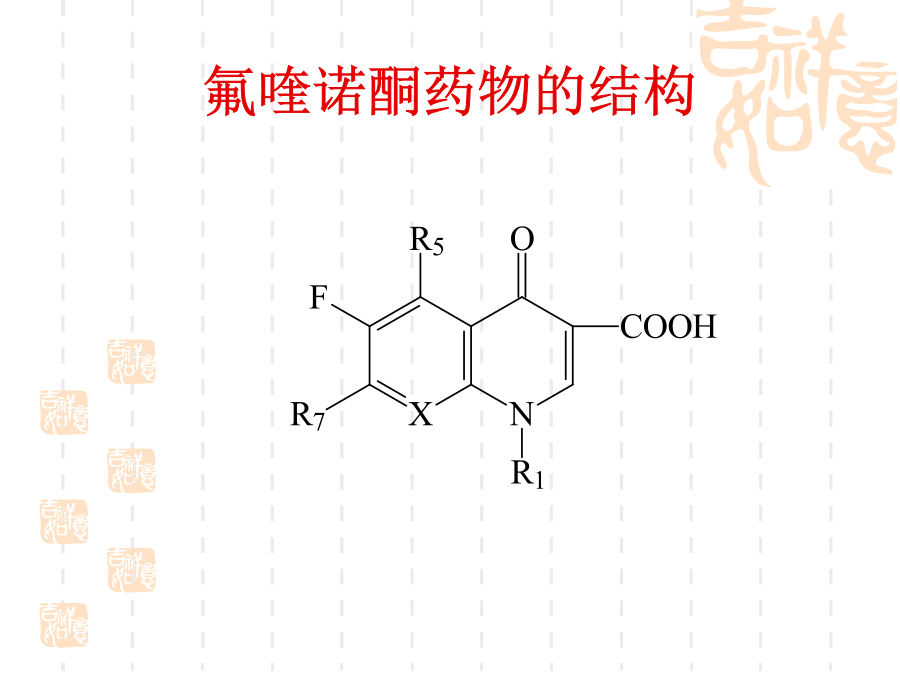
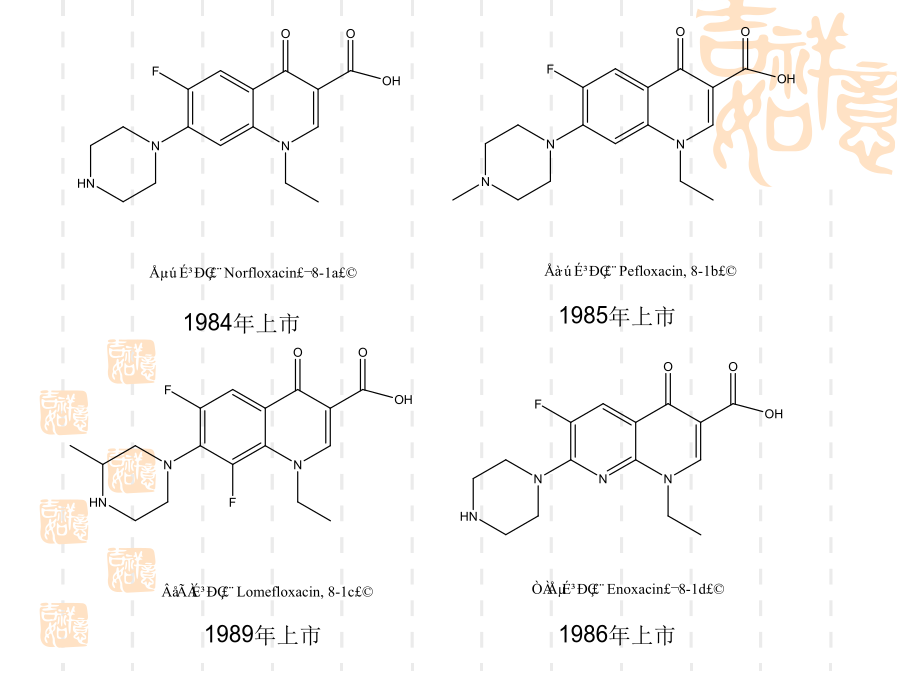
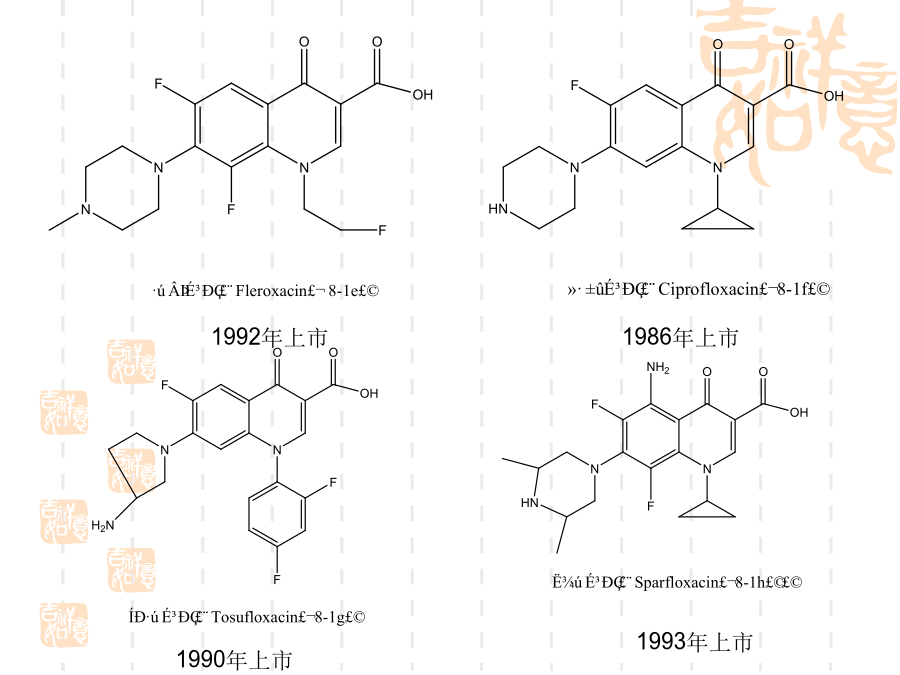
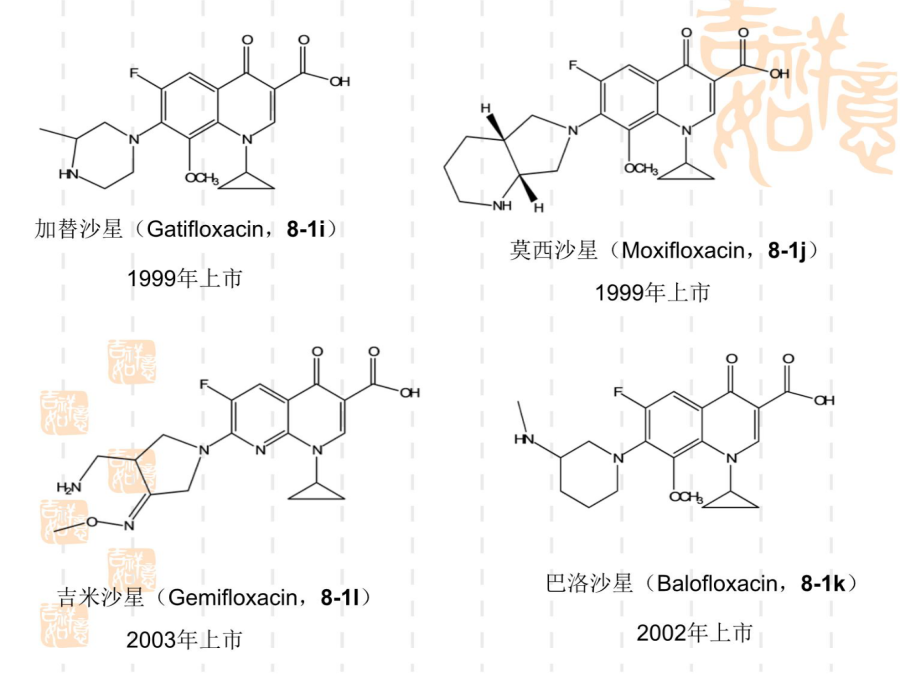
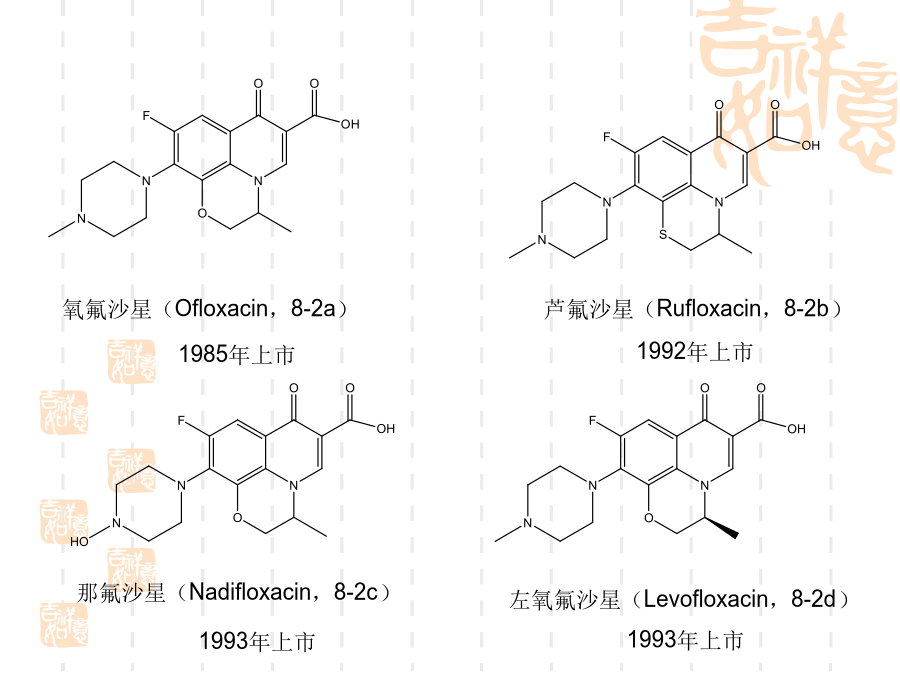
氟喹诺酮药物的合成技术一、简介氟喹诺酮药物的结构1992年上市氧氟沙星(Ofloxacin,8-2a)帕珠沙星(Pazufloxacin,8-2e)8.2、喹诺酮环的形成喹诺酮1位接有乙基的药物如诺氟沙星和洛美沙星等,应用此法制备最为简便。取代苯胺8-4与乙氧亚甲基(EMME)在120~130ºC反应得取代苯胺基亚甲基丙二酸二乙酯8-5,该步反应的收率一般可达100%,8-5不经分离在高温环合,即构成喹诺酮环8-6,8-6a或8-6b可进一步合成诺氟沙星和培氟沙星,8-6c可合成洛美沙星和氟罗沙星。8-5

氟喹诺酮药物的合成技术.ppt
氟喹诺酮药物的合成技术一、简介氟喹诺酮药物的结构1992年上市加替沙星(Gatifloxacin8-1i)氧氟沙星(Ofloxacin8-2a)帕珠沙星(Pazufloxacin8-2e)8.2、喹诺酮环的形成喹诺酮1位接有乙基的药物如诺氟沙星和洛美沙星等应用此法制备最为简便。取代苯胺8-4与乙氧亚甲基(EMME)在120~130ºC反应得取代苯胺基亚甲基丙二酸二乙酯8-5该步反应的收率一般可达100%8-5不经分离在高温环合即构成喹诺酮环8-68-6a或8-6b可进一步合成诺氟沙星和培氟沙星8-

氟喹诺酮药物的合成技术.ppt
氟喹诺酮药物的合成技术一、简介氟喹诺酮药物的结构1992年上市加替沙星(Gatifloxacin8-1i)氧氟沙星(Ofloxacin8-2a)帕珠沙星(Pazufloxacin8-2e)8.2、喹诺酮环的形成喹诺酮1位接有乙基的药物如诺氟沙星和洛美沙星等应用此法制备最为简便。取代苯胺8-4与乙氧亚甲基(EMME)在120~130ºC反应得取代苯胺基亚甲基丙二酸二乙酯8-5该步反应的收率一般可达100%8-5不经分离在高温环合即构成喹诺酮环8-68-6a或8-6b可进一步合成诺氟沙星和培氟沙星8-

喹诺酮药物的比较ppt课件.ppt
喹诺酮类药物的比较定义萘啶酸四代喹诺酮药物比较改变构效后喹诺酮药物特点呼吸喹诺酮类抗菌药物体内过程体内过程体内过程体内过程不良反应不良反应不良反应不良反应不良反应不良反应不良反应注意事项注意事项

喹诺酮药物的比较PPT课件.ppt
喹诺酮类药物的比较定义萘啶酸四代喹诺酮药物比较改变构效后喹诺酮药物特点呼吸喹诺酮类抗菌药物体内过程体内过程体内过程体内过程不良反应不良反应不良反应不良反应不良反应不良反应不良反应注意事项注意事项感谢亲观看此幻灯片,此课件部分内容来源于网络,如有侵权请及时联系我们删除,谢谢配合!
