
结核分枝杆菌膜蛋白的异源表达与纯化研究进展.pdf

as****16





在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

结核分枝杆菌膜蛋白的异源表达与纯化研究进展.pdf
!"卷#期微生物学报!("#):’($)’(*$%%"年&%月!日!"#$%&"’()&(*(+&"$,&-&"$!+,-./01$%%"!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!结核分枝杆菌膜蛋白的异源表达与纯化研究进展廖丹&,谢建平&,$",王洪海$(&西南大学生命科学学院现代生物医药研究所重庆!%%"&#)($复旦大学生命科学学院遗传学研究所遗传工程国家重点实验室上海$%%!(()摘要:膜蛋白是一类与生物膜相互作用、具

结核分枝杆菌Rv3369基因的表达和纯化.pdf
!"卷#期微生物学报!("#):’(#)’(*$%%"年&%月!日!"#$%&"’()&(*(+&"$,&-&"$!+,-./01$%%"!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!结核分枝杆菌./!!"#基因的表达和纯化吕冲,姜昕,顾晓玲,王洪海"(复旦大学生命科学学院遗传学研究所遗传工程国家重点实验室上海$%%!(()摘要:在大肠杆菌中高效表达结核分枝杆菌JH(("F蛋白,获得纯化的重组蛋白1JH(("F。通过聚合酶链反应

浅谈重组结核分枝杆菌Mr-38-000蛋白的表达、纯化和鉴定.docx
浅谈重组结核分枝杆菌Mr38000蛋白的表达、纯化和鉴定摘要从H37Rv基因组中扩增Mr38000蛋白基因并高效表达和纯化。用PCR技术从结核分枝杆菌H37Rv基因组中扩增Mr38000蛋白序列,将其与pGEM-T-Easy载体连接转化DH5α,构建重组克隆载体pGEM-T-Easy/Mr38000,测序正确后将目的基因片断克隆入pQE-80L原核表达载体并转化DH5α,IPTG诱导目的蛋白表达。经Western-blot鉴定目的基因与(His)6融合表达,将已表达的蛋白质通过Ni-NTA亲和色谱柱进行纯
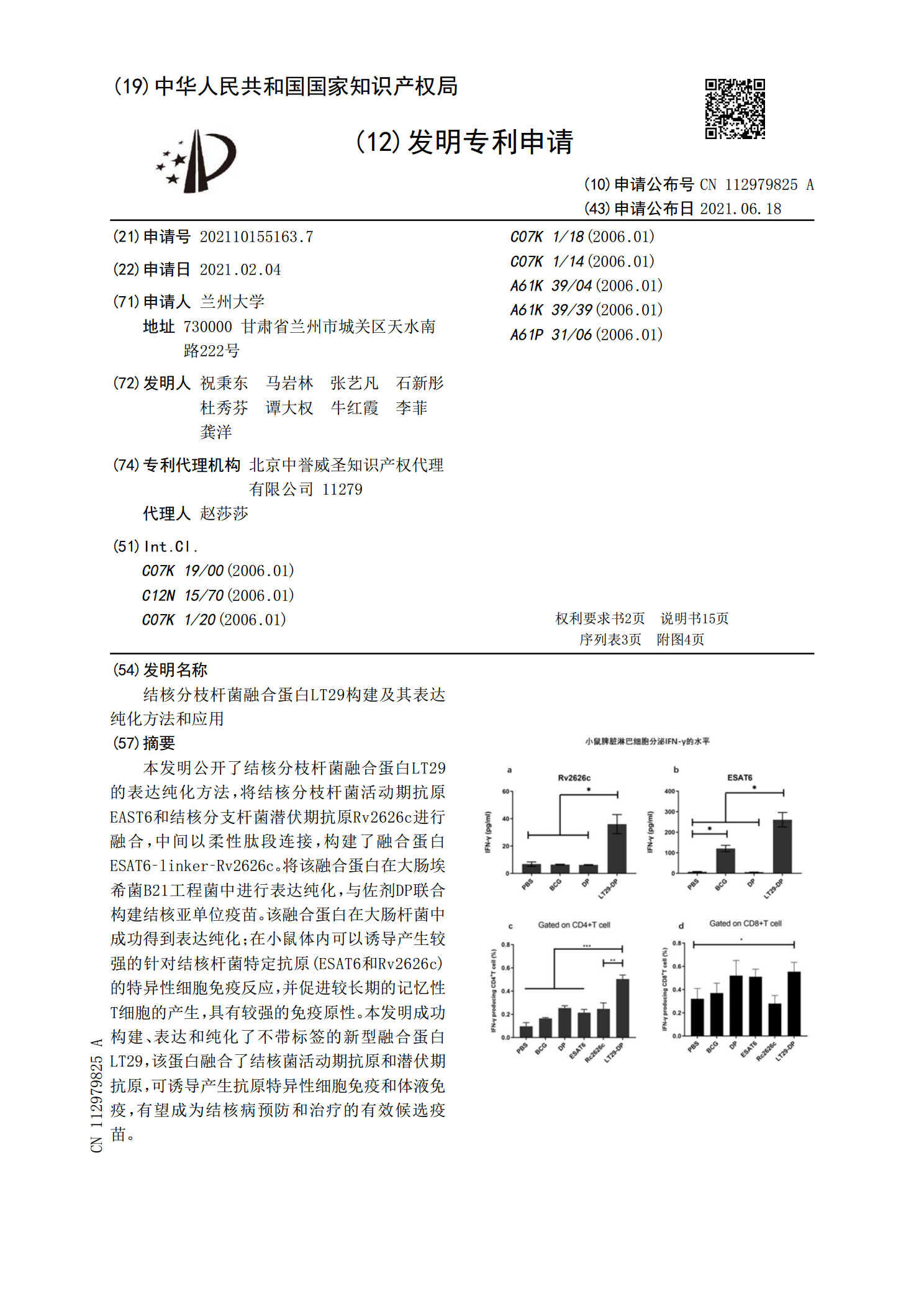
结核分枝杆菌融合蛋白LT29构建及其表达纯化方法和应用.pdf
本发明公开了结核分枝杆菌融合蛋白LT29的表达纯化方法,将结核分枝杆菌活动期抗原EAST6和结核分支杆菌潜伏期抗原Rv2626c进行融合,中间以柔性肽段连接,构建了融合蛋白ESAT6‑linker‑Rv2626c。将该融合蛋白在大肠埃希菌B21工程菌中进行表达纯化,与佐剂DP联合构建结核亚单位疫苗。该融合蛋白在大肠杆菌中成功得到表达纯化;在小鼠体内可以诱导产生较强的针对结核杆菌特定抗原(ESAT6和Rv2626c)的特异性细胞免疫反应,并促进较长期的记忆性T细胞的产生,具有较强的免疫原性。本发明成功构建、

结核分枝杆菌抗原及其研究进展.pdf
医学综述2012年6月第18卷第11期MedicalRecapitulate,Jun.2012,Vol.18,No.11·1609·分子生物医学结核分枝杆菌抗原及其研究进展1△2※石磊(综述),陈苏红(审校)(1.解放军301医院,北京100853;2.军事医学科学院放射与辐射医学研究所,北京100850)中图分类号:R446.6文献标识码:A文章编号:1006-2084(2012)11-1609-03摘要:结核病是危害人类健康的最大传染病之一。结核分枝杆菌抗原遗传背景较复杂,且个体蛋白用于单项诊断结核病
