
【精选】酶的提取与分离纯化(2).ppt

春景****23









亲,该文档总共47页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

【精选】酶的提取与分离纯化.ppt
酶的提取与分离纯化要点1细胞破碎机械破碎法物理破碎法化学破碎法酶促破碎法2提取提取方法影响提取的主要因素3沉淀分离盐析沉淀法盐析沉淀法盐析沉淀法等电点沉淀法有机溶剂沉淀法复合沉淀法选择性变性沉淀法4离心分离离心机的选择离心方法的选用密度梯度离心等密度梯度离心离心条件的确定离心力离心时间沉降时间温度和PH5过滤和膜

【精选】酶的提取与分离纯化(2).ppt
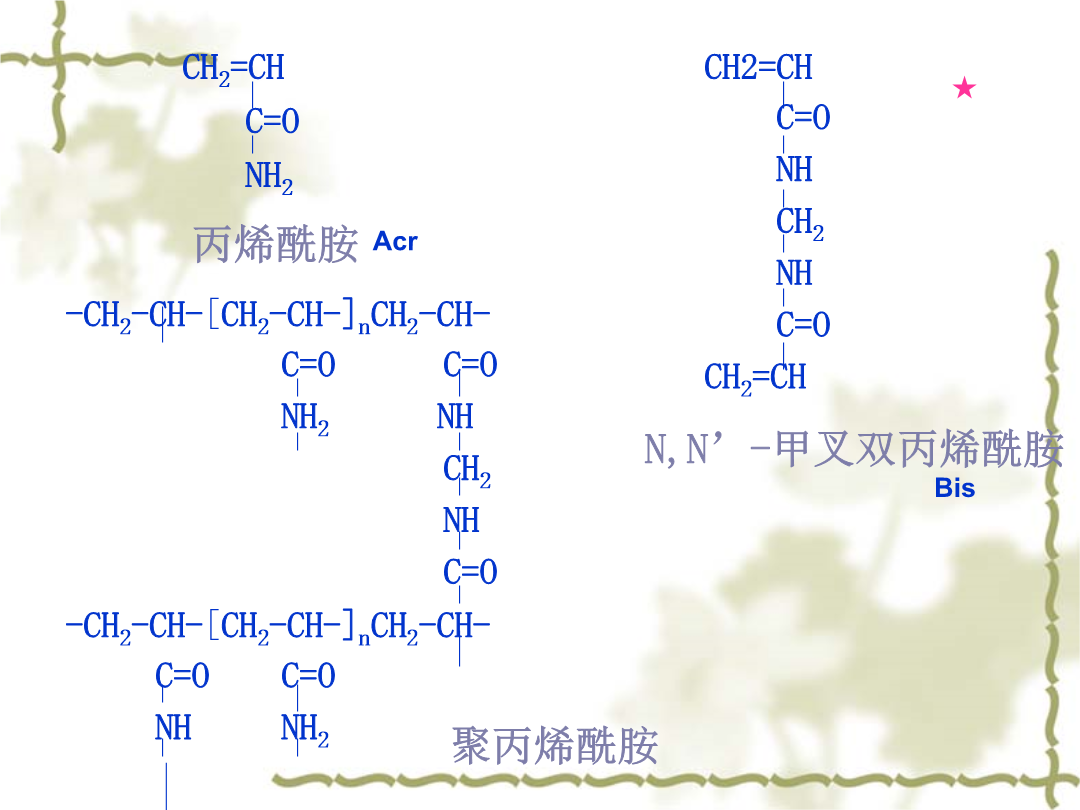
第三章酶的提取与分离纯化一、电泳的基本理论1.原理:影响迁移率的因素:颗粒性质:Q越大、r越小、形状越接近球形v越快。电场强度:E越高v越快。电泳液:pH值:离pI越远v越快。(用buffer保持恒定)离子强度:离子强度越高v越低。通常缓冲液离子强度在0.02-0.2之间。电渗:在电场中液体对于固体支持物的相对移动。应避免用高电渗物质作支持介质。自由界

酶的提取与分离纯化.ppt
............................................................................................................

酶的提取与分离纯化.ppt
酶工程23基因工程酶/蛋白分离纯化的一般流程67891012131415161718192021222324252627282930313233343536373839404142434445464748495051525354555657585960616263646566676869707172737475767778798081828384858687888990919293949596979899100101102103104105106107108109110111112113114115116

酶的提取和分离纯化.ppt
11酶的提取与分离纯化思考题本章主要内容11.酶的提取、分离纯化11.1酶的提取、纯化的基本原则注意点酶分离纯化的工艺流程设计酶分离纯化的工艺流程设计材料选择及其前处理11.2细胞破碎11.2.1机械破碎法机械破碎法11.2.2物理破碎法1.温度差破碎法2.压力差破碎法Manton-Gaulinhomogeniservalve压力差破碎法压力差破碎法3.超声波破碎法11.2.3化学破碎法(1)有机溶剂处理(2)表面活性剂处理11.2.4酶学破碎法2.自溶法丙酮干粉的制备11.3酶的抽提(萃取、提取)抽提剂
