
九年级化学第十一单元 盐 化肥 复习学案 人教版.doc

星星****眨眼




在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

九年级化学第十一单元 盐 化肥 复习学案 人教版.doc
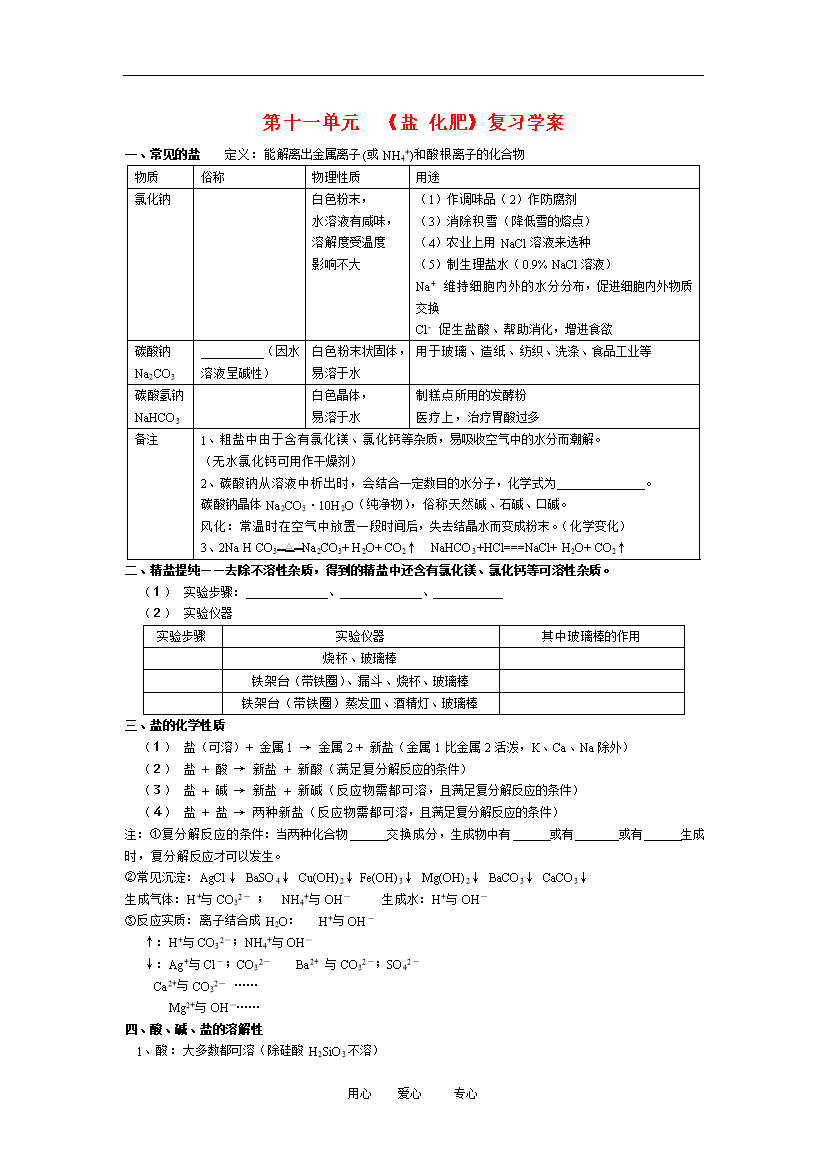
第十一单元《盐化肥》复习学案一、常见的盐定义:能解离出金属离子(或NH4+)和酸根离子的化合物物质俗称物理性质用途氯化钠白色粉末水溶液有咸味溶解度受温度影响不大(1)作调味品(2)作防腐剂(3)消除积雪(降低雪的熔点)(4)农业上用NaCl溶液来选种(5)制生理盐水(0.9%NaCl溶液)Na+维持细胞内外的水分分布促进细胞内外物质交换Cl-促生盐酸、帮助消化增进食欲碳酸钠Na2CO3(因水溶液呈碱性)白色粉末状固体易溶于水用于玻璃、造纸、纺织、洗涤、食品工业等

九年级化学第十一单元 盐 化肥 复习学案 人教版.doc
第十一单元《盐化肥》复习学案一、常见的盐定义:能解离出金属离子(或NH4+)和酸根离子的化合物物质俗称物理性质用途氯化钠白色粉末,水溶液有咸味,溶解度受温度影响不大(1)作调味品(2)作防腐剂(3)消除积雪(降低雪的熔点)(4)农业上用NaCl溶液来选种(5)制生理盐水(0.9%NaCl溶液)Na+维持细胞内外的水分分布,促进细胞内外物质交换Cl-促生盐酸、帮助消化,增进食欲碳酸钠Na2CO3(因水溶液呈碱性)白色粉末状固体,易溶于水用于玻璃、造纸、纺织、洗涤、食品工业等碳酸氢钠NaHCO3白色晶体,易溶

化学第十一单元盐、化肥复习.ppt
第十一单元课时教学目标1.了解氯化钠、碳酸钠、碳酸氢钠和碳酸钙的组成及其在生活中的主要用途;2.能根据复分解反应的发生条件判断酸、碱、盐之间的反应能否发生;3.掌握碳酸根离子的检验方法;4.学习蒸发操作技能并综合运用相尖操作分离、提纯固体混合物;5.了解化学元素对植物生长工重要性及常见化肥的种类和作用;6.了解化肥、农药对环境的影响。教学设想重点:1.复分解反应的条件及酸、碱、盐之间的复分解反应。2.分离提纯物质的基本操作技能,以及化学与生活生产的关系;3.几种常见盐的性质和用途。难点:酸、碱、盐之间的相
学案-全国-2009_九年级化学第十一单元 盐 化肥 复习学案 人教版.rar
用心爱心专心第十一单元《盐化肥》复习学案一、常见的盐定义:能解离出金属离子(或NH4+)和酸根离子的化合物物质俗称物理性质用途氯化钠白色粉末,水溶液有咸味,溶解度受温度影响不大(1)作调味品(2)作防腐剂(3)消除积雪(降低雪的熔点)(4)农业上用NaCl溶液来选种(5)制生理盐水(0.9%NaCl溶液)Na+维持细胞内外的水分分布,促进细胞内外物质交换Cl-促生盐酸、帮助消化,增进食欲碳酸钠Na2CO3(因水溶液呈碱性)白色粉末状固体,易溶于水用于玻璃、造纸、纺
学案-全国-2010_九年级化学 第十一单元 《盐 化肥》复习学案人教版.rar
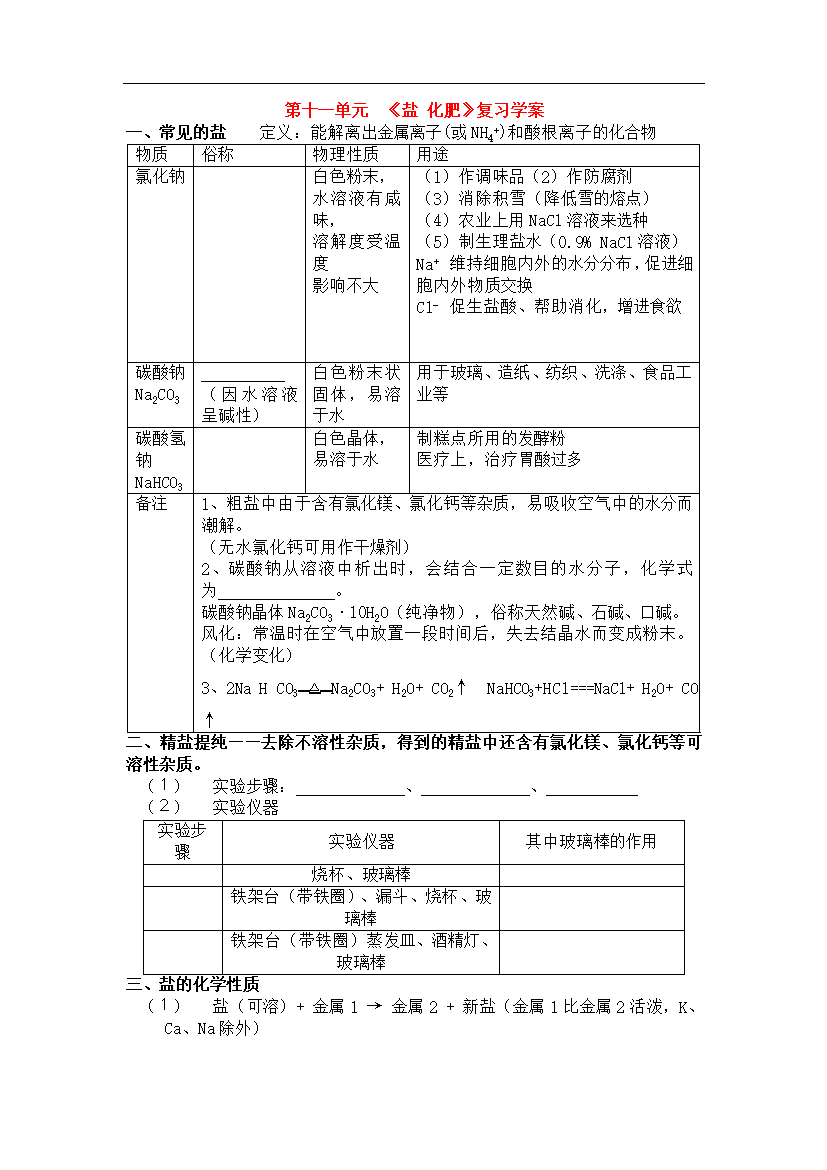
第十一单元《盐化肥》复习学案一、常见的盐定义:能解离出金属离子(或NH4+)和酸根离子的化合物物质俗称物理性质用途氯化钠白色粉末,水溶液有咸味,溶解度受温度影响不大(1)作调味品(2)作防腐剂(3)消除积雪(降低雪的熔点)(4)农业上用NaCl溶液来选种(5)制生理盐水(0.9%NaCl溶液)Na+维持细胞内外的水分分布,促进细胞内外物质交换Cl-促生盐酸、帮助消化,增进食欲碳酸钠Na2CO3(因水溶液呈碱性)白色粉末状固体,易溶于水用于玻璃、造纸、纺织、洗涤、食品
