
(天津专用)高考化学一轮复习 专题五 化学能与热能课件-人教版高三全册化学课件.pptx

猫巷****奕声









亲,该文档总共109页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

(天津专用)高考化学一轮复习 专题五 化学能与热能课件-人教版高三全册化学课件.pptx
专题五化学能与热能A组自主命题·天津卷题组一定条件下的密闭容器中该总反应达到平衡要提高CO的转化率可以采取的措施是(填字母代号)。a.高温高压b.加入催化剂c.减少CO2的浓度d.增加CO的浓度e.分离出二甲醚(4)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下在密闭容器中加入CH3OH反应到某时刻测得各组分的浓度如下:解析(3)根据盖斯定律①×2+②+③得总反应总反应的ΔH=-90.8kJ/mol×2+(-23

(山东专用)高考化学一轮复习 专题五 化学能与热能课件-人教版高三全册化学课件.pptx
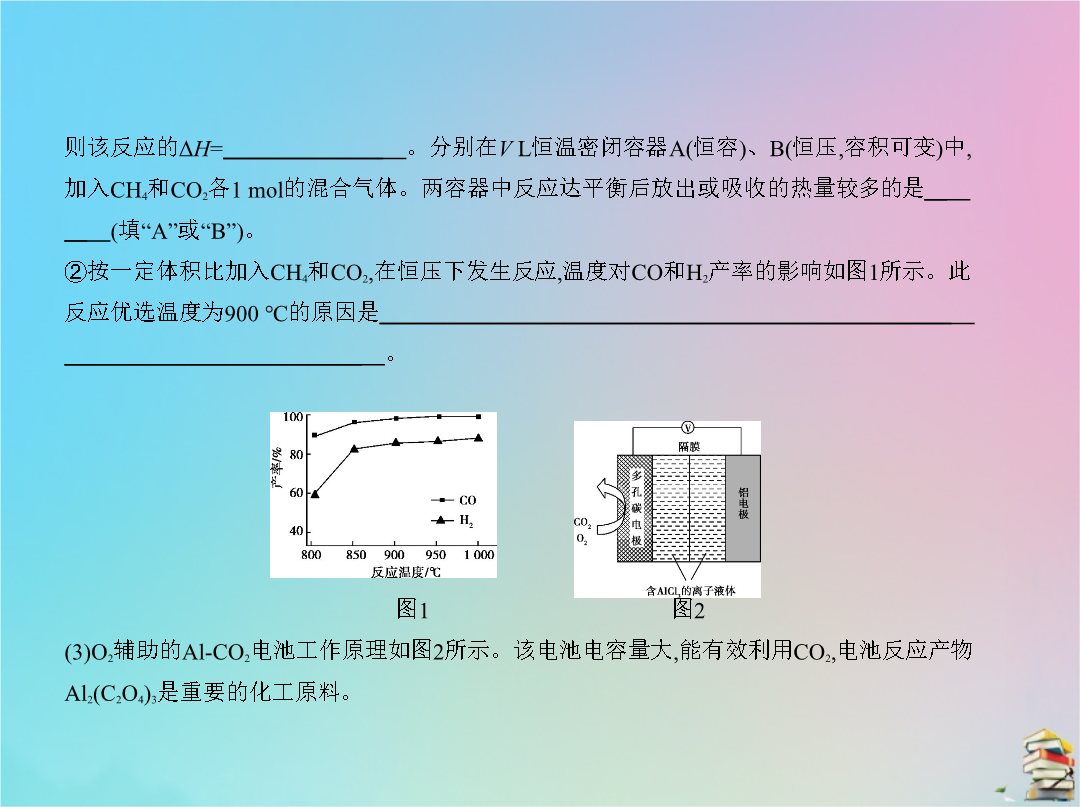
专题五化学能与热能五年高考考点二热化学方程式的书写与盖斯定律通过计算可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为、制得等量H2所需能量较少的是。(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g)。在610K时将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中反应平衡后水的物质的量分数为0.02。①H2S的平衡转化率α

(新课标Ⅱ)高考化学一轮复习 专题五 化学能与热能课件-人教版高三全册化学课件.ppt
专题五化学能与热能考点一化学反应中能量变化的有关概念及计算(2015课标Ⅱ2714分0.321)甲醇既是重要的化工原料又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇发生的主要反应如下:①CO(g)+2H2(g) CH3OH(g)ΔH1②CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2③CO2(g)+H2(g) CO(g)+H2O(g)ΔH3回答下列问题:(1)已知反应①中相关的化学键键能数据如下:由此计算ΔH1=

(新课标Ⅰ)高考化学一轮复习 专题五 化学能与热能课件-人教版高三全册化学课件.ppt
专题五化学能与热能考点一化学反应中能量变化的有关概念及计算1.(2015课标Ⅱ2714分0.321)甲醇既是重要的化工原料又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇发生的主要反应如下:①CO(g)+2H2(g) CH3OH(g)ΔH1②CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2③CO2(g)+H2(g) CO(g)+H2O(g)ΔH3回答下列问题:(1)已知反应①中相关的化学键键能数据如下:由此计算ΔH1=

(新课标Ⅱ)高考化学一轮复习 专题五 化学能与热能课件-人教版高三全册化学课件.ppt
专题五化学能与热能考点一化学反应中能量变化的有关概念及计算(2015课标Ⅱ2714分0.321)甲醇既是重要的化工原料又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇发生的主要反应如下:①CO(g)+2H2(g) CH3OH(g)ΔH1②CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2③CO2(g)+H2(g) CO(g)+H2O(g)ΔH3回答下列问题:(1)已知反应①中相关的化学键键能数据如下:由此计算ΔH1=
