
(新课标Ⅱ)高考化学一轮复习 专题五 化学能与热能课件-人教版高三全册化学课件.ppt

永香****能手





亲,该文档总共80页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

(新课标Ⅰ)高考化学一轮复习 专题五 化学能与热能课件-人教版高三全册化学课件.ppt
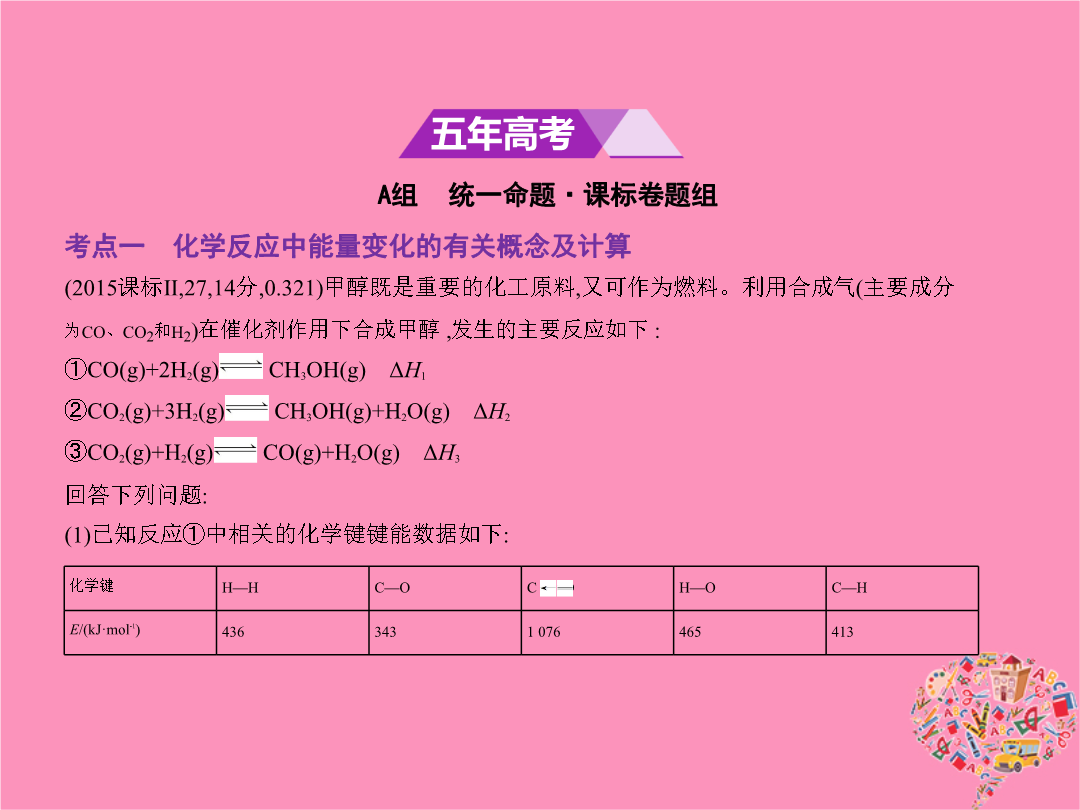
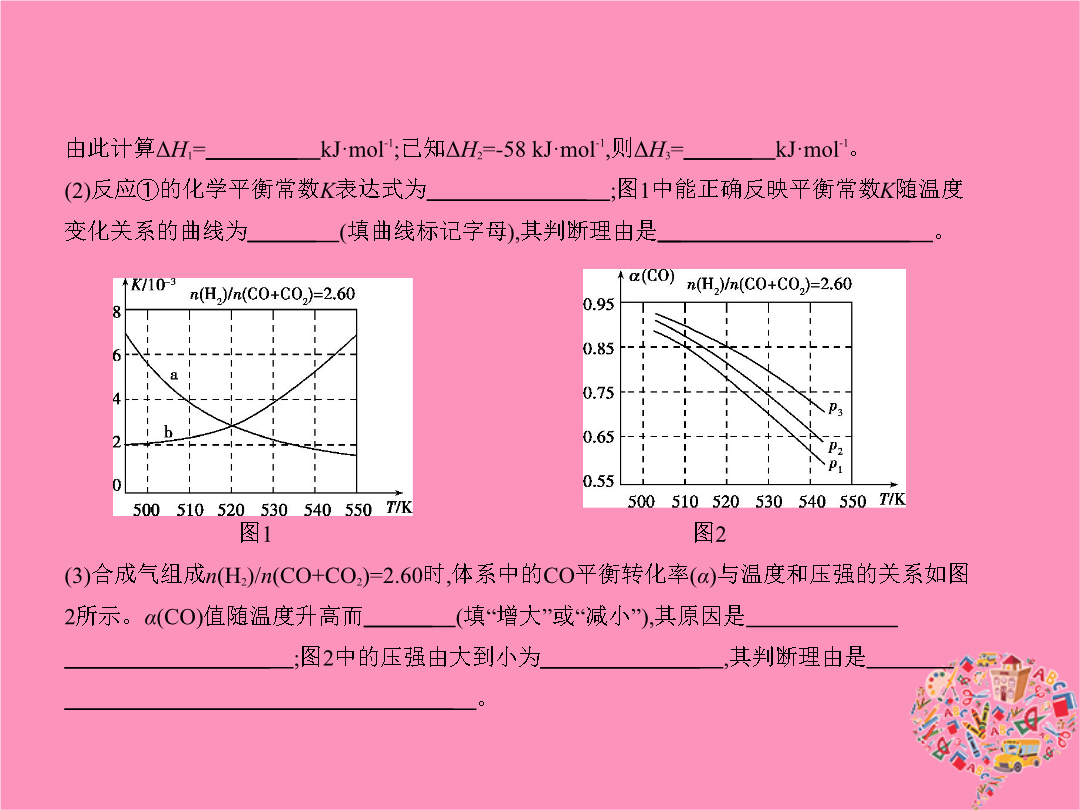
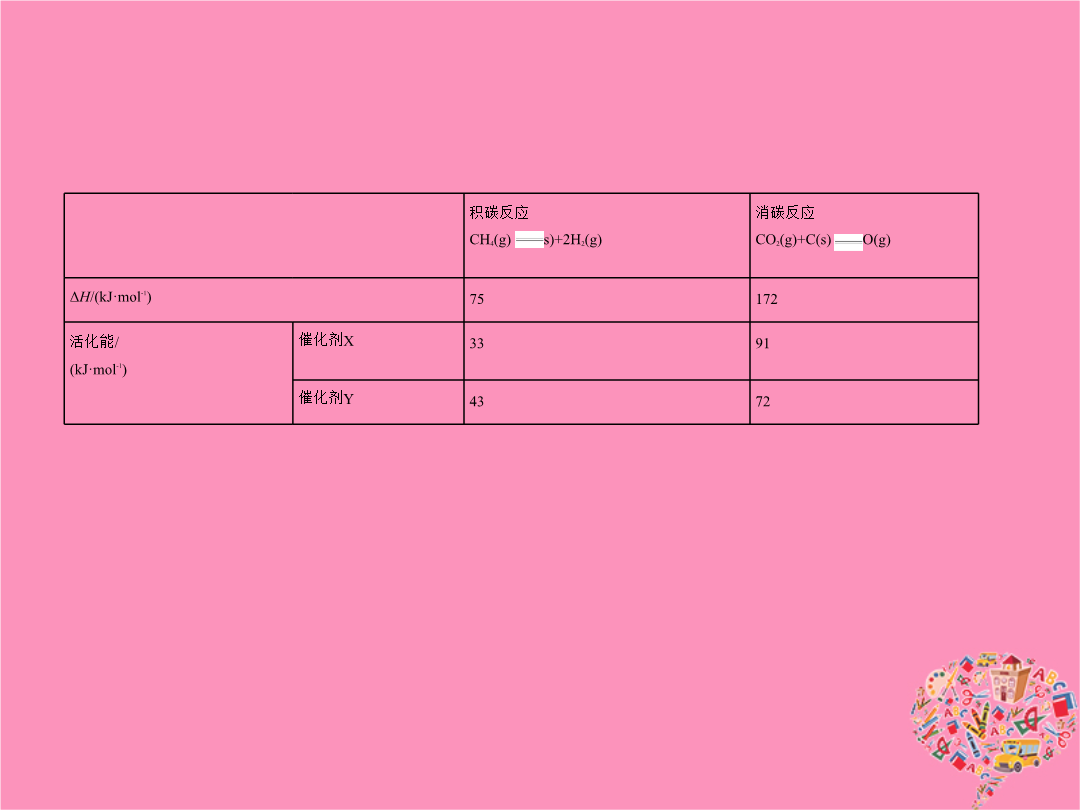
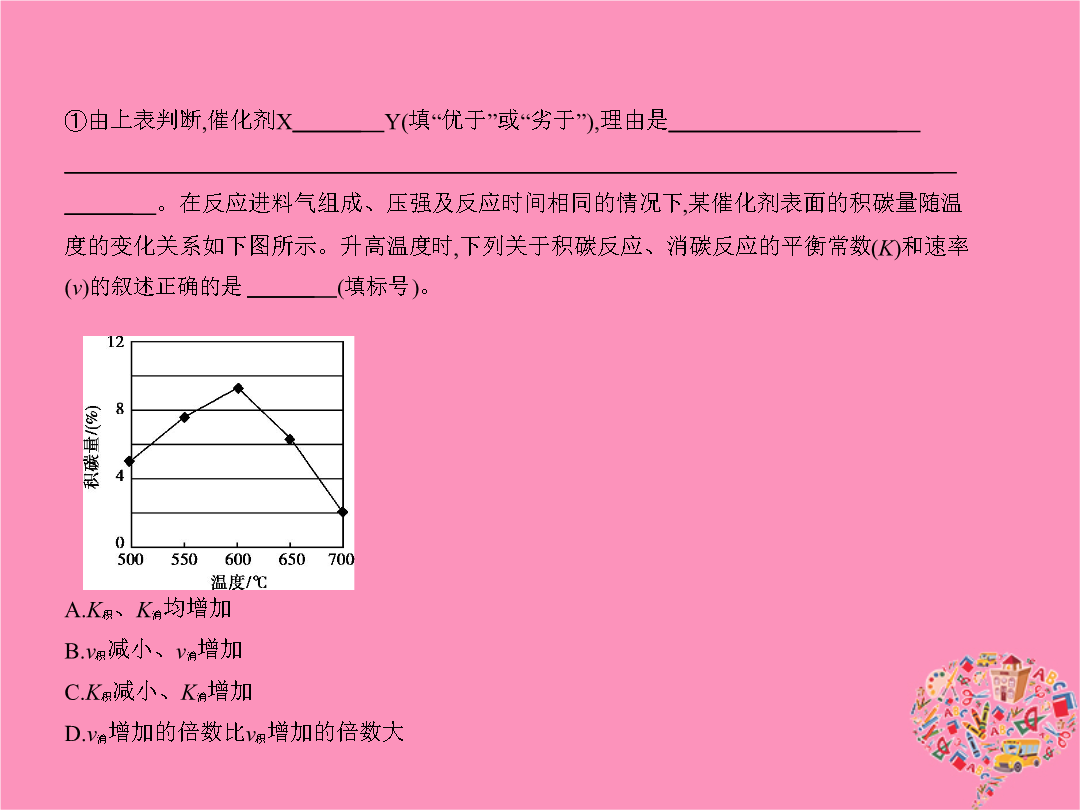
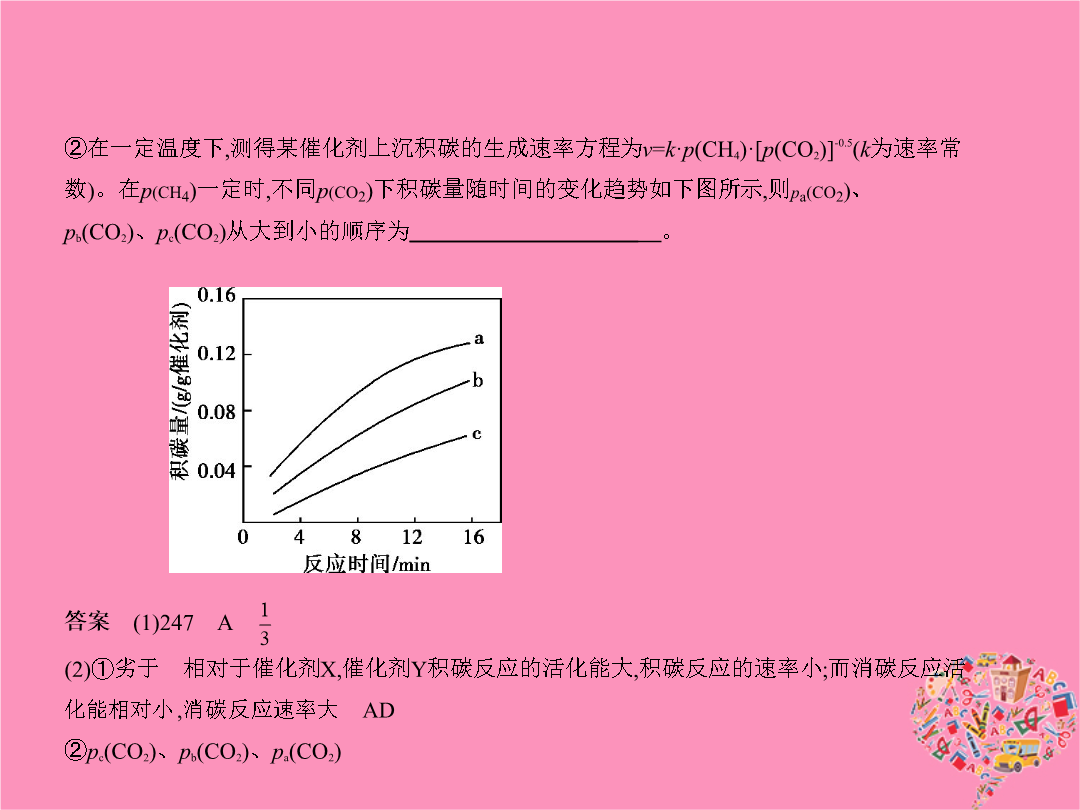
专题五化学能与热能考点一化学反应中能量变化的有关概念及计算1.(2015课标Ⅱ2714分0.321)甲醇既是重要的化工原料又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇发生的主要反应如下:①CO(g)+2H2(g) CH3OH(g)ΔH1②CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2③CO2(g)+H2(g) CO(g)+H2O(g)ΔH3回答下列问题:(1)已知反应①中相关的化学键键能数据如下:由此计算ΔH1=

(新课标Ⅱ)高考化学一轮复习 专题五 化学能与热能课件-人教版高三全册化学课件.ppt
专题五化学能与热能考点一化学反应中能量变化的有关概念及计算(2015课标Ⅱ2714分0.321)甲醇既是重要的化工原料又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇发生的主要反应如下:①CO(g)+2H2(g) CH3OH(g)ΔH1②CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2③CO2(g)+H2(g) CO(g)+H2O(g)ΔH3回答下列问题:(1)已知反应①中相关的化学键键能数据如下:由此计算ΔH1=

(新课标Ⅱ)高考化学一轮复习 专题五 化学能与热能课件-人教版高三全册化学课件.ppt
专题五化学能与热能考点一化学反应中能量变化的有关概念及计算(2015课标Ⅱ2714分0.321)甲醇既是重要的化工原料又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇发生的主要反应如下:①CO(g)+2H2(g) CH3OH(g)ΔH1②CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2③CO2(g)+H2(g) CO(g)+H2O(g)ΔH3回答下列问题:(1)已知反应①中相关的化学键键能数据如下:由此计算ΔH1=

(新课标Ⅰ)高考化学一轮复习 专题五 化学能与热能课件-人教版高三全册化学课件精编.ppt
专题五化学能与热能考点一化学反应中能量变化的有关概念及计算1.(2015课标Ⅱ,27,14分,0.321)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:①CO(g)+2H2(g) CH3OH(g)ΔH1②CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2③CO2(g)+H2(g) CO(g)+H2O(g)ΔH3回答下列问题:(1)已知反应①中相关的化学键键能数据如下:由此计算ΔH1=kJ·mol-1;已知ΔH2=-

(新课标Ⅲ)高考化学 专题五 化学能与热能课件-人教版高三全册化学课件精编.pptx
专题五化学能与热能A组统一命题·课标卷题组考点一化学反应中能量变化的有关概念及计算(2015课标Ⅱ,27,14分,0.321)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:①CO(g)+2H2(g) CH3OH(g)ΔH1②CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2③CO2(g)+H2(g) CO(g)+H2O(g)ΔH3回答下列问题:(1)已知反应①中相关的化学键键能数据如下:由此计算ΔH1=kJ·mol
