
化学反应进行的方向省公共课一等奖全国赛课获奖课件.pptx

可爱****乐多







亲,该文档总共24页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

化学反应进行的方向省公共课一等奖全国赛课获奖课件.pptx
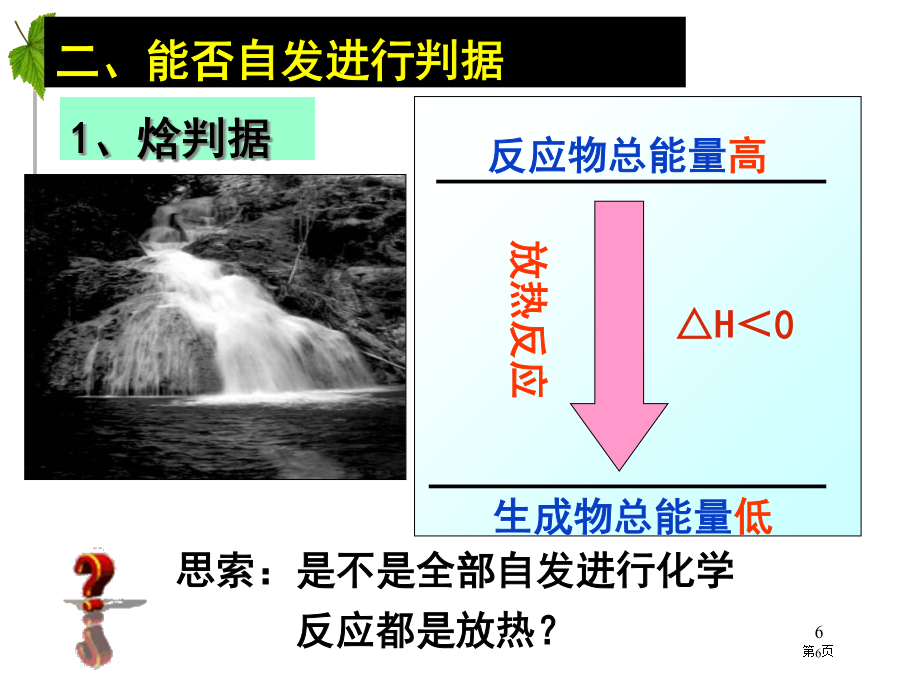
第二章化学反应速率和化学平衡自发反应:在一定条件(温度、压强等)下不需外界帮助就能自动进行反应,称为自发反应。www.themegallery.com以下反应在一定条件下都能自发进行,你知道这些反应能自发进行主要原因吗?C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2217.5kJ·mol-12Na(s)+Cl2(g)=2NaCl(s)△H=-822kJ·mol-14Fe(s)+3O2(g)=Fe2O3(s)△H=-1648.4kJ·mol-1H2(g)+F2(g)=2HF(g)△H

化学反应进行的方向省公共课一等奖全国赛课获奖课件.pptx
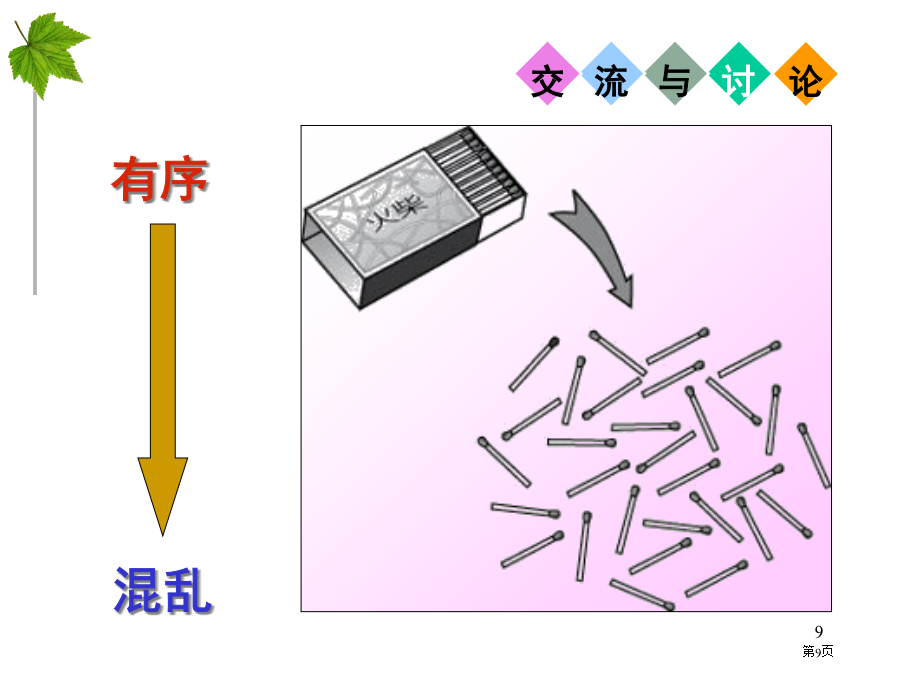
第二章化学自发反应:在一定条件下,不需外界帮助就能自动进行反应,称为自发反应。自然界中水总是从高处往低处流;电流总是从电位高地方向电位低地方流动;室温下冰块自动融化;墨水扩散;食盐溶解于水;火柴棒散落等。以下反应在一定条件下都能自发进行,你知道这些反应能自发进行主要原因吗?C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2217.5kJ·mol-12Na(s)+Cl2(g)=2NaCl(s)△H=-822kJ·mol-14Fe(s)+3O2(g)=Fe2O3(s)△H=-1648.4k

高中化学选修四化学反应进行的方向省公共课一等奖全国赛课获奖课件.pptx
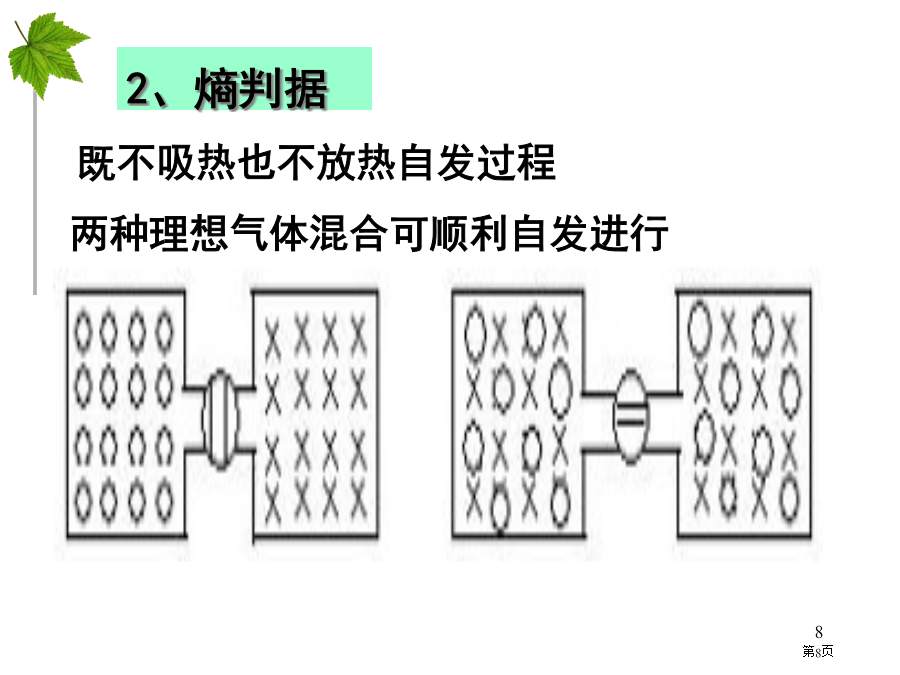
第四节化学反应进行方向生活中自发过程化学反应中自发过程一、自发过程与焓判据练习1练习2有些过程也是自发,这当中有与物质能量高低无关,有虽与能量高低相关,但用焓判据却无法解释清楚,比如:二、熵、熵增原理、熵判据三、焓判据和熵判据应用练习3练习41.过程自发性只能用于判断过程方向,不能确定过程是否一定会发生和过程发生速率。比如:金刚石有向石墨转化倾向,不过能否发生,什么时候发生,多快才能完成,就不是能量判据和熵判据能处理问题了。小结2、吸热自发过程应为熵增加过程,如冰融化、硝酸铵溶于水等。

化学反应的方向速率和限度省公共课一等奖全国赛课获奖课件.pptx
1、自发过程与非自发过程自发过程共同基本特征:高处水(2)自发过程含有作功能力。(3)自发过程有一定程度。2、影响化学反应方向原因不过在现实中有不少吸热过程也是自发过程。在不一样状态下,组成系统微观粒子运动混乱程度不一样熵概念初步热力学第三定律标准摩尔熵(1)物质含微粒越多,结构越复杂,熵值越大。(4)同一物质体积越大,熵值越大。课堂练习:dD+eESm213.669.94228.0205.0NH4Cl(s)=NH3(g)+HCl(g)△rSm=284.94J·mol-1·K-1△rHm=176.9

化学反应的方向和判断依据省公共课一等奖全国赛课获奖课件.pptx
化学反应的方向自发进行化学反应高处水向低处流是一个可自动进行过程,那么低处水能够流至高处吗?一自发反应:在一定温度和压强下,无需外界帮助就能自动进行反应,我们称之为自发反应。二判断化学反应方向依据判断以下过程中能量改变情况:熵:衡量一个体系混乱度物理量,符号:S熵变:反应前后体系熵改变。符号:ΔS依据你已经有知识经验,判断以下过程熵变大于零还是小于零。①H2O(s)→H2O(l)→H2O(g)②NaOH(s)==Na+(aq)+OH-(aq)1、同一物质,S(g)﹥S(l)﹥S(s);2、分子数越多或分子
