
物理化学实验w市公开课一等奖百校联赛特等奖课件.pptx

人生****奋斗








亲,该文档总共59页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

物理化学实验w市公开课一等奖百校联赛特等奖课件.pptx
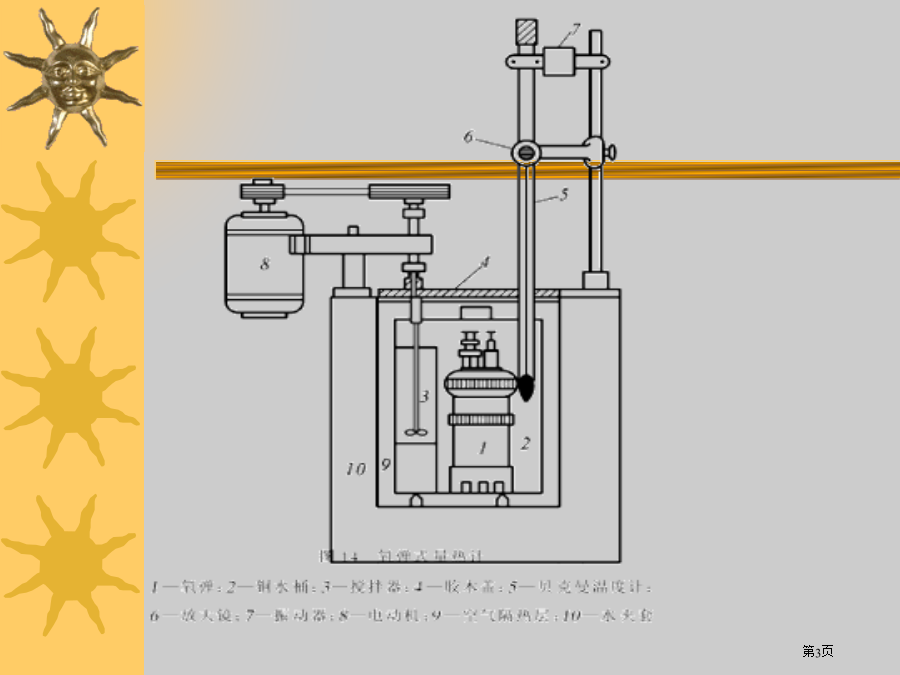
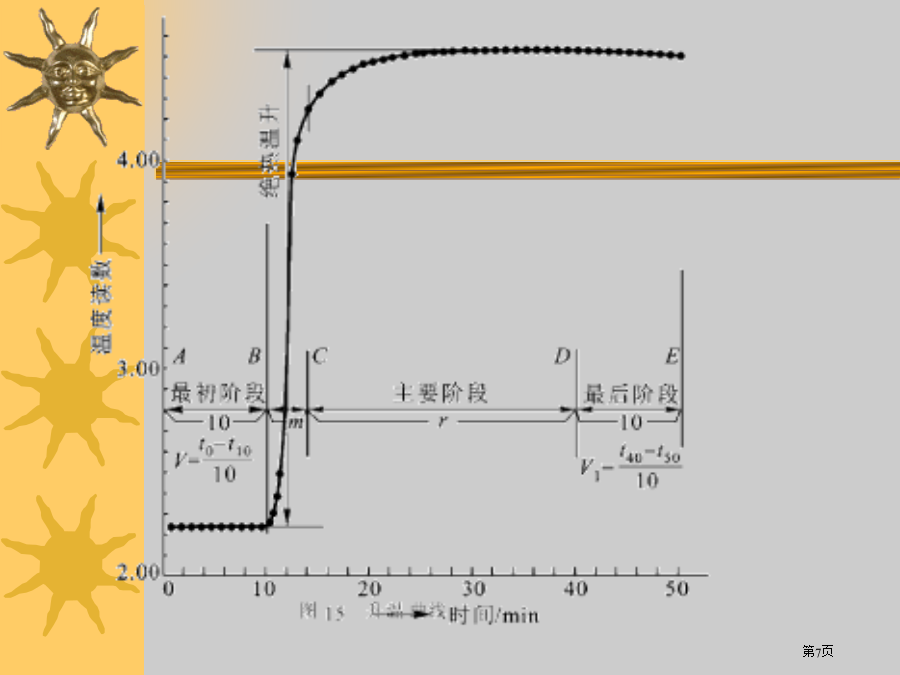
物理化学试验试验一、燃烧热测定1.1摩尔物质完全氧化时反应热称为燃烧热,所谓完全氧化是指CCO2(g),H2H2O(l),SSO2(g),而N、卤素、银等元素变为游离状态。如在25oC苯甲酸燃烧热-3226.8kj/mol。C7H6O2(s)+71/2O2(g)→7CO2(g)+3H2O(l)燃烧热可在恒容或恒压情况下测定,由热力学第一定律可知:在不做非膨胀功情况下,恒容燃烧热Qv=Δu,恒压燃烧热Qp=ΔH,在氧弹式量热计中测得燃烧热为Qv,而普通热化学计算用值为Qp,这二者可经过下式进行换算:Qp=Q

物理化学实验讲座-110920市公开课一等奖百校联赛特等奖课件.pptx
物理化学实验物理化学试验基本要求一、试验预习(10%)试验前预习是顺利完成试验基本确保,经过预习,要求对试验基本原理、试验方法、仪器使用、数据处理等方面内容做到心中有数,防止盲目地边看讲义边操作。详细预习内容以下:要求了解试验目标、试验方法、所用仪器设备等,掌握试验基本原理、试验操作要领以及试验数据处理方法等。防止试验时盲目性。要求在预习本中预先画出规范数据统计格式,包含试验项目,测试内容、测量次数等。要求对预习时所碰到难点、疑点和构想等提出讨论,培养学习主动性和主动性。试验预习须在试验前按试验安排进行,

物理化学实验电子教案市公开课一等奖百校联赛特等奖课件.pptx
物理化学试验电子教案液体饱和蒸气压与温度关系实验目及要求试验原理试验原理试验原理试验原理试验原理试验原理仪器和试剂试验步骤试验步骤数据处理数据处理思索题附录1温度计校正附录1温度计校正附录2用Matlab处理数据附录2用Matlab处理数据附录2用Matlab处理数据附录2用Matlab处理数据附录3压力测量附录3压力测量附录3压力测量附录3压力测量附录3压力测量附录3压力测量附录3压力测量附录3压力测量附录3压力测量附录3压力测量附录3压力测量附录3压力测量附录3压力测量附录3压力测量附录3压力测量附录

物理化学(00001)市公开课一等奖百校联赛特等奖课件.pptx
第三章热力学第二定律Chapter3theSecondLowofThermodynamics主要内容定义:自动发生改变,即无需外力帮忙,任其自然,不去管它,即可发生改变。(1)水从高往低处流,它逆过程水从低往高处流不会自动进行。(3)锌片投入硫酸铜溶液引发置换反应,它逆过程也不会自动发生。等等……2.自发过程逆向进行环境必须对系统做功1)自发过程是热力学不可逆过程。4.热机效率5.热力学第二定律1卡诺循环由两个恒温可逆过程和两个绝热可逆过程组成、以理想气体为工作介质理想循环。(1)等温可逆膨胀经一循环后,

数学实验课件市公开课一等奖百校联赛特等奖课件.pptx
数学试验何谓“数学试验”数学试验干些什么事?数学试验不干什么事?课程目如实统计试验现象,禁止试验造假。独立完成试验内容,禁止剽窃作业。按时交汇报。5.22之前提交三次汇报,发至邮箱:projectliya@gmail.com依据个人情况选择若干研究问题。试验汇报格式上机课程参考教材试验一:微积分基础Plot[f[x],{x,a,b},PlotStyle->{RGBColor[1,0,0]}]RGBColor表示红、绿、蓝三色百分比。Show[fg1,fg2](几个图象重新显示在同一坐标系里)sin(x)及
