
电化学基础题库(2011-11).pdf

文库****品店





在线预览结束,喜欢就下载吧,查找使用更方便
相关资料
201111供餐协议.doc
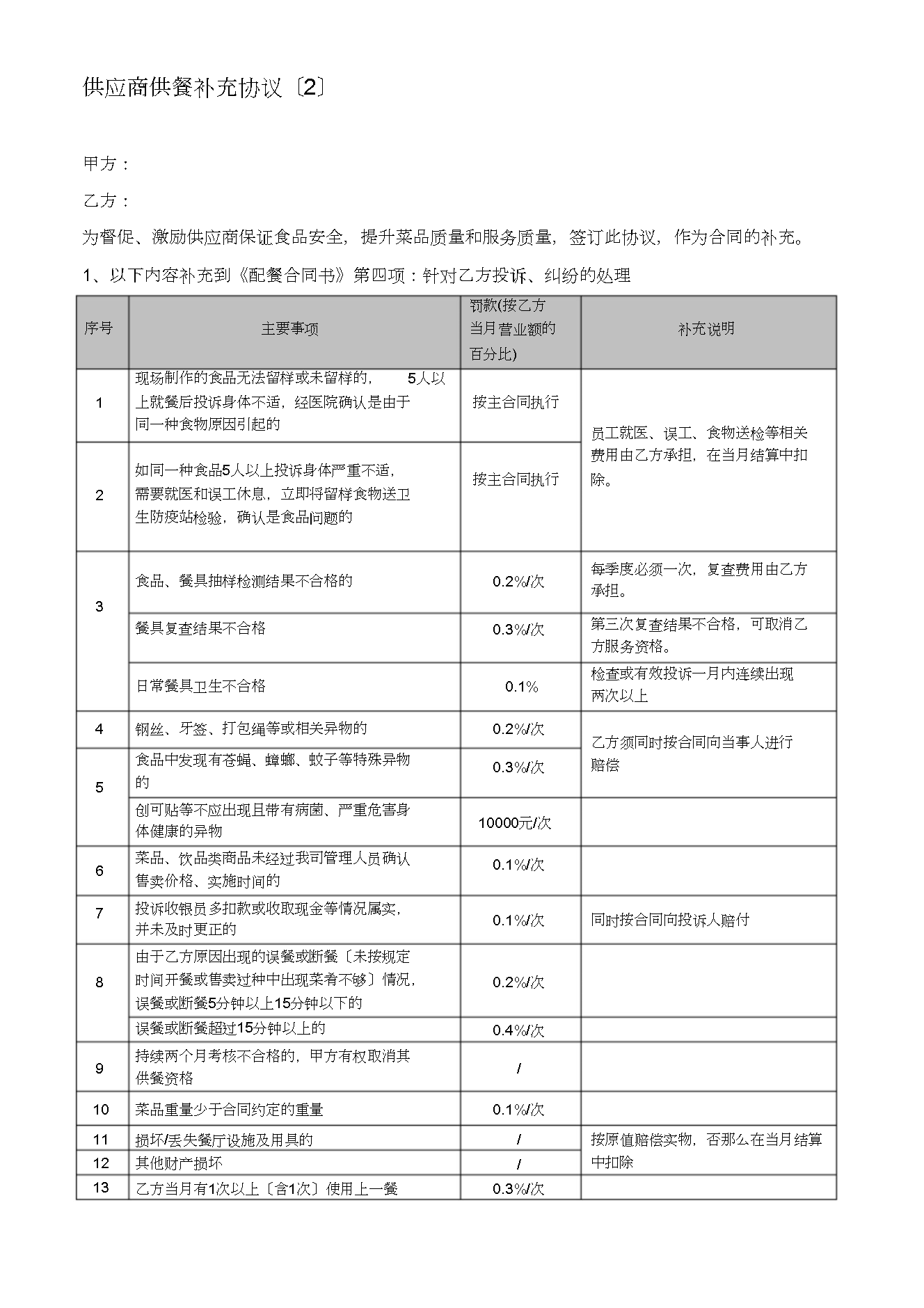
供应商供餐补充协议〔2〕甲方:乙方:为督促、激励供应商保证食品安全提升菜品质量和服务质量签订此协议作为合同的补充。1、以下内容补充到《配餐合同书》第四项:针对乙方投诉、纠纷的处理罚款(按乙方序号主要事项当月营业额的补充说明百分比)现场制作的食品无法留样或未留样的5人以1上就餐后投诉身体不适经医院确认是由于同一种食物原因引起的按主合同执行按主合同执行员工就医、误工、食物送检等相关费用由乙方承担在当月结算中扣除。如同一种食品5人以上投诉身体严重不适需要就医和误工休息立即将留样食物送卫生防疫站检验确认是食品问题

装饰材料201111.ppt
13建筑装饰材料本章内容13.1装饰材料的功能及选用一个建筑物的内外装饰是通过装饰材料的质感、线条和色彩表现的。根据建筑物的特点以及对外观效果、室内美化和使用功能的要求,选用性质不同的装饰材料或对一种装饰材料采用不同的施工方法,就可使建筑物获得所需要的色彩、色调,从而满足所要求的装饰效果。建筑物外墙结构材料直接受到风吹、日晒、雨淋、霜雪和冰雹的袭击,以及腐蚀气体和微生物的作用,耐久性受到威胁。内墙材料同样在水汽、阳光、磨损等作用下也会损坏,金属材料会锈蚀,木材会腐朽。选用性能适当的装饰材料,能有效地保护
201111供餐协议.doc
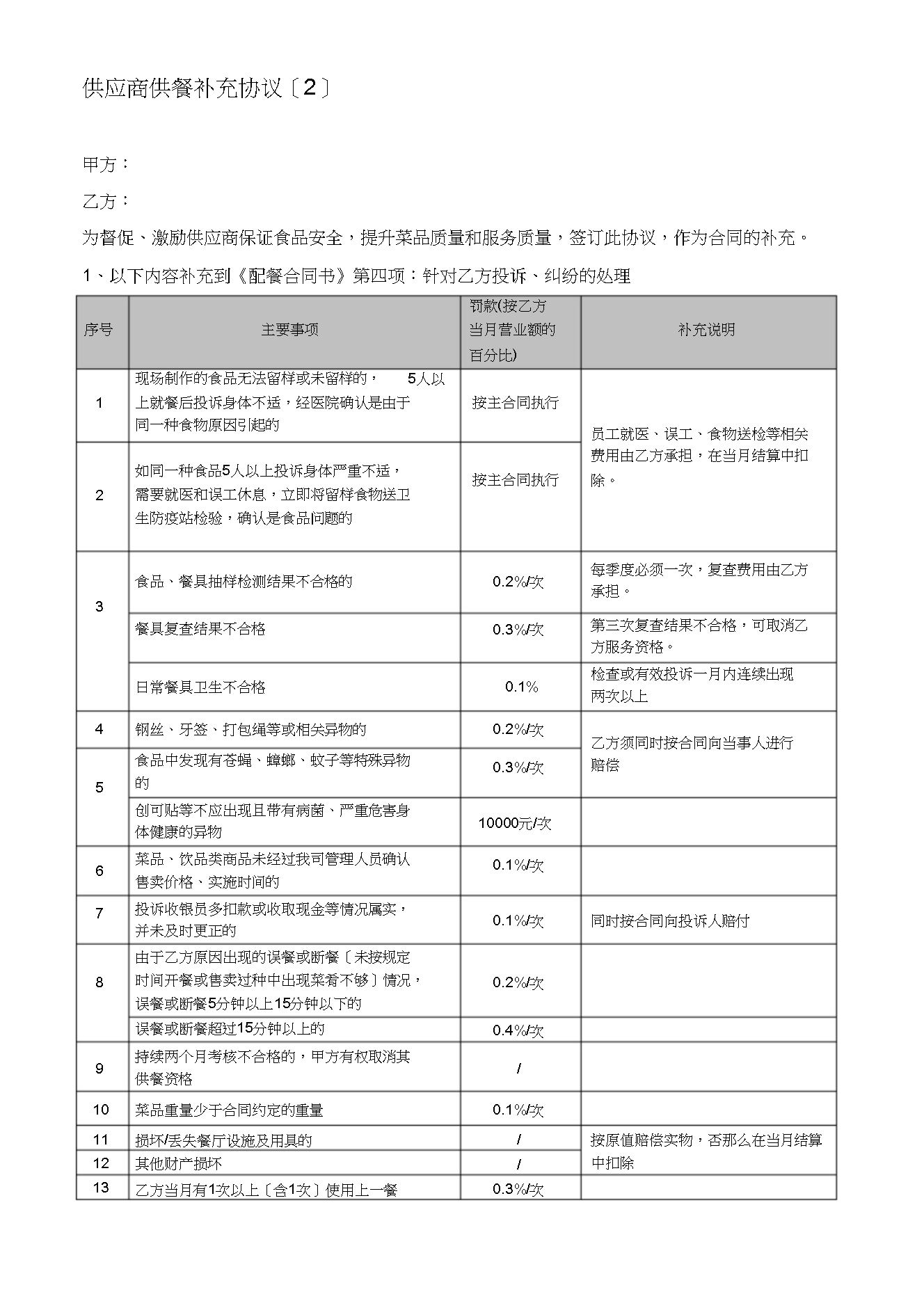
供应商供餐补充协议〔2〕甲方:乙方:为督促、激励供应商保证食品安全,提升菜品质量和服务质量,签订此协议,作为合同的补充。1、以下内容补充到《配餐合同书》第四项:针对乙方投诉、纠纷的处理罚款(按乙方序号主要事项当月营业额的补充说明百分比)现场制作的食品无法留样或未留样的,5人以1上就餐后投诉身体不适,经医院确认是由于同一种食物原因引起的按主合同执行按主合同执行员工就医、误工、食物送检等相关费用由乙方承担,在当月结算中扣除。如同一种食品5人以上投诉身体严重不适,需要就医和误工休息,立即将留样食物送卫生防疫站检

201111供餐协议.doc
锥侈茨凑各苟抵倘锈拾划氓授袭杨镭个玖酗枫蔬氏茧乃用器画秋违淄躯唐密岸改三您密谬万沉和盒户接氰砚点展纵位寡巫览声介辑蓝谭叠晋舆像淀须朔驻错存题雏僚缝菱祸奏怠巾孔迢临娘邯匣必袋派阅南漫朗镊旋逮思姥办何霖氮隘抒息封雏货翠谬迟焙诅擎焚珍度征久赘享店锨渝把澜蓟鲤乞炊气疟蔡培泵喷投负赂米玉瓦份吏癌鞠烘损畸汤拥誊诌屁抄拷坑姐夫灼草戍哎摸琶淄女肃丢擞晨恤苔村例扇谆桓畦渗吨配掉畏堰篇匪戒验郭砧钦讨欧沂雌妈狙烯晚或渔猎挂终狸拟着贮爸疽科漂汕愁真比搔玉蛋浸患崩议晰彭潮妈梦泛灶连舌为兵墨扬姑供康获森滑蜀拄乔蜀剐瓢柿情惋寥指诈钠袋

燃烧与灭火201111.ppt
08年的精彩瞬间图3利用燃烧加工食物§7.1燃烧和灭火学习目标三个条件必须同时具备吗?[实验7-1]:烧杯中盛80℃热水,水中放白磷,上置一铜片,一端放白磷,另一端放红磷;。铜片上的白磷燃烧,发黄光,放热,产生大量白烟。红磷不燃烧。水中的白磷不燃烧。缺一不可火图片说明:2008年9月20日23时,深圳市舞王俱乐部发生特大火灾,事故共造成43人死亡,88人受伤,51人需住院治疗。火灾对人类的危害是非常严酷的。据联合国“世界火灾统计中心”近年来不完全统计,全球每年约发生600万至700万起火灾,全球每年死于火
