
试题-江苏-2017_江苏省常州市武进区中考化学专题讲解 常见的酸练习(无答案) 沪教版.doc

Ma****57










亲,该文档总共13页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

试题-江苏-2017_江苏省常州市武进区中考化学专题讲解 常见的酸练习(无答案) 沪教版.doc
常见的酸知识讲解板块一认识酸、碱、盐酸的特点:酸可以看作是由氢元素和酸根组成酸在水溶液中能解离出导电的阴、阳离子,并且生成的阳离子全部都是氢离子(H+)特例(NaHSO4)酸H+(阳离子)+酸根离子(阴离子)不同的酸在水中的阴离子是不同的,如SO42-,NO3-,Cl-等都称为酸根离子。不能说是酸就一定有酸味,绝大部分的酸都没有酸味。大部分酸都溶于水。碱的特点:碱可以看作是由金属元素和氢氧根组成。碱在水溶液中都能解离出可导电的阴、阳离子,并且生成的阴离子全部都是氢氧根离子(OH-)。碱金属离子(阳离子)+

试题-江苏-2017_江苏省常州市武进区中考化学专题讲解 常见的碱练习(无答案) 沪教版.doc
常见的碱知识讲解板块一常见的碱常见的碱氢氧化钠[NaOH]氢氧化钙[Ca(OH)2]颜色、状态白色颗粒状固体白色粉末状固体溶解性易溶、且溶解时放出大量的热微溶腐蚀性强腐蚀性较强腐蚀性俗名苛性钠、火碱、烧碱熟石灰、消石灰用途重要化工原料,应用于肥皂、石油、造纸、纺织、印染等工业;生活中可用来除油污。重要的建筑材料,也是一种工业原料。如漂白粉,农业上用于改良酸性土壤,农药波尔多液。说明1.NaOH易潮解,易吸收CO2生成Na2CO3发生变质,因此要密封保存。2.由于NaOH易溶于水,而Ca(O
试题-江苏-2017_江苏省常州市武进区中考化学专题讲解 实验专题练习(无答案) 沪教版.doc
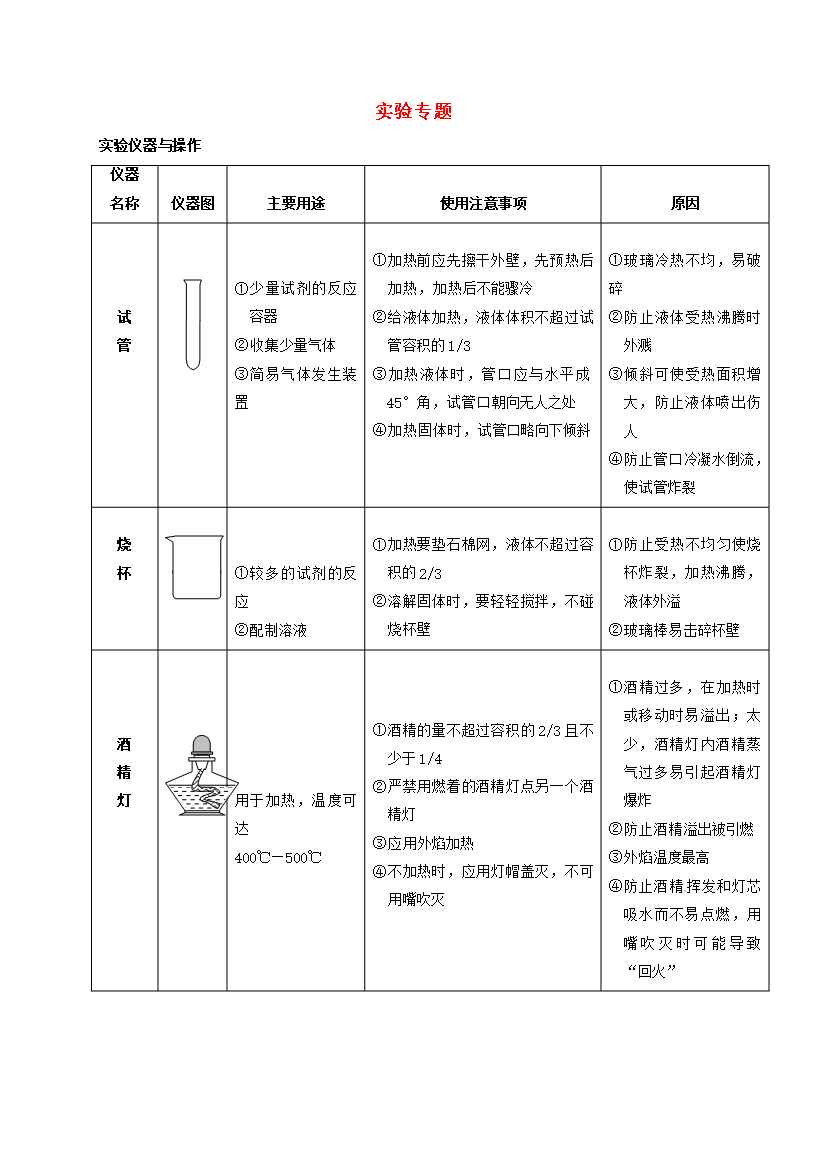
实验专题实验仪器与操作仪器名称仪器图主要用途使用注意事项原因试管①少量试剂的反应容器②收集少量气体③简易气体发生装置①加热前应先擦干外壁,先预热后加热,加热后不能骤冷②给液体加热,液体体积不超过试管容积的1/3③加热液体时,管口应与水平成45°角,试管口朝向无人之处④加热固体时,试管口略向下倾斜①玻璃冷热不均,易破碎②防止液体受热沸腾时外溅③倾斜可使受热面积增大,防止液体喷出伤人④防止管口冷凝水倒流,使试管炸裂烧杯①较多的试剂的反应②配制溶液①加热要垫石棉网,液体不超过容积的2/3②溶解固体时,要轻轻搅拌
试题-江苏-2017_江苏省常州市武进区中考化学专题讲解 氧气的制取练习(无答案) 沪教版.doc
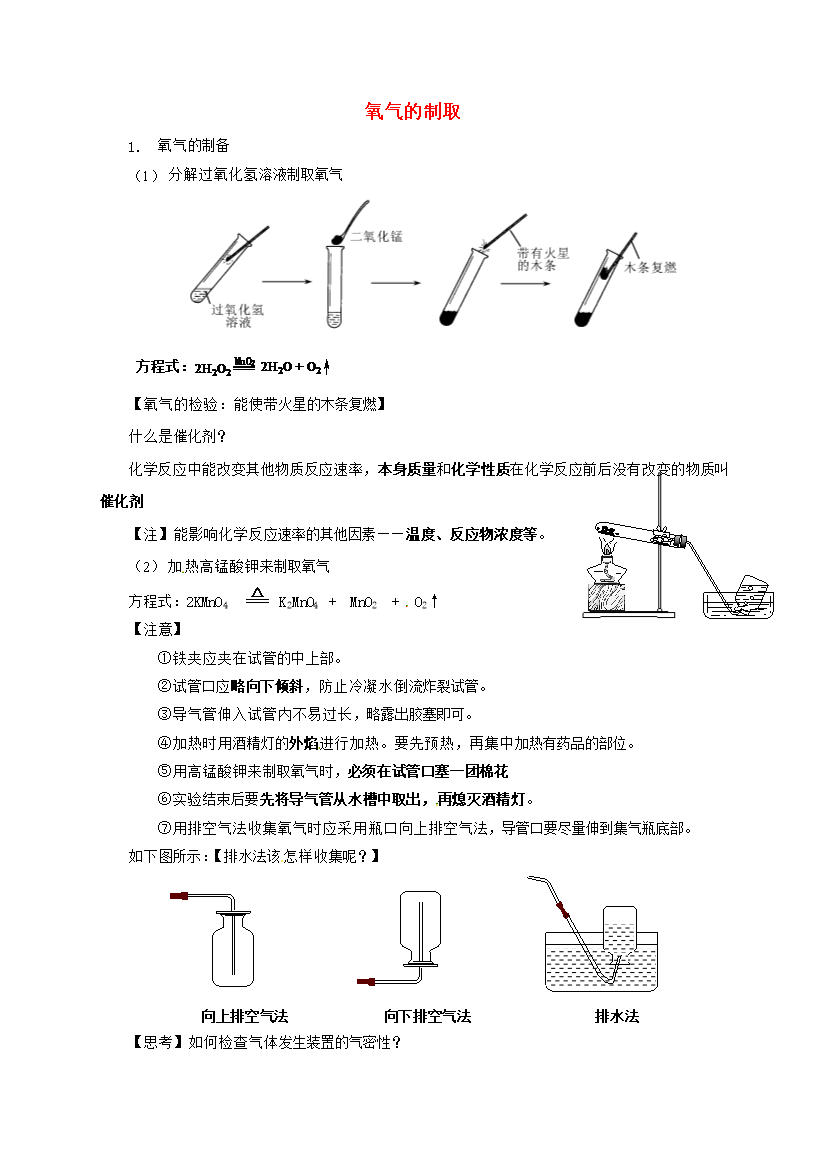
氧气的制取氧气的制备分解过氧化氢溶液制取氧气方程式:【氧气的检验:能使带火星的木条复燃】什么是催化剂?化学反应中能改变其他物质反应速率,本身质量和化学性质在化学反应前后没有改变的物质叫催化剂【注】能影响化学反应速率的其他因素——温度、反应物浓度等。加热高锰酸钾来制取氧气方程式:2KMnO4K2MnO4+MnO2+O2↑【注意】①铁夹应夹在试管的中上部。②试管口应略向下倾斜,防止冷凝水倒流炸裂试管。③导气管伸入试管内不易过长,略露出胶塞即可。④加热时用酒精灯的外焰进行加热。

试题-江苏-2017_江苏省常州市武进区中考化学专题讲解 氧气的性质练习(无答案) 沪教版.doc
氧气的性质氧气的物理性质通常情况下,氧气是一种无色、无味的气体,密度比空气略大。氧气不易溶于水。在1.01×105Pa下,-183℃时为淡蓝色液体,在-218℃时为淡蓝色雪花状固体。氧气的化学性质支持呼吸,维持生命活动——宇航员呼吸、潜水、急救……木炭燃烧:【现象】在空气中保持红热;在氧气中比在空气中燃烧更旺,发出白光,并放出大量热量,燃烧后生成一种能使澄清石灰水变浑浊的气体——二氧化碳(CO2)。化学方程式:C+O2CO2硫燃烧:【现象】硫在空气中燃烧时发出微弱的淡蓝色火焰,而在氧
