
高等有机化学电子效应和溶剂效应.pptx

胜利****实阿










亲,该文档总共36页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

高等有机化学电子效应和溶剂效应.pptx
上述有机化合物分子的酸性变化,都是分子中电子云密度分布发生了变化,或者从另一个角度说键的极性发生变化的结果。有机分子中,由于电负性不同的取代基的影响沿着键链传递,致使分子中电子云密度按取代基相对于氢的电负性所决定的方向而偏移的效应,叫做诱导效应。(I)诱导效应可表示为:提问:F>CN为什么?请解释〉对于+I效应也是同样规律,Na(0.9)的电负性小于Mg(1.2),前者的活性要大得多,同样,由于Li的电负性(1.0)很小,给电子能力大于Mg,因此有机锂试剂活性大于格氏试剂,有很强的亲核能力.为什么?请解释

高等有机化学电子效应.pptx
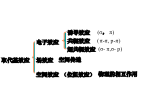
第三章有机化学中的电子效应和空间效应吸引电子能力(电负性较大)比氢原子强的原子或原子团(如—X、—OH、—NO2、—CN等)有吸电子的诱导效应(负的诱导效应),用-I表示,整个分子的电子云偏向取代基。诱导效应强弱变化规律:D.带正电荷的基团具有吸电子诱导效应,带负电荷的基团具有给电子诱导效应。分子在外界电场(试剂、溶剂、极性容器)的影响下,键的极性也发生一些改变,这种现象叫极化性。不同的共价键,对外界电场的影响有不同的感受能力,这种感受能力通常叫做可极化性。C—X键的极性:C—F>C—Cl>C—Br>C

高等有机化学电子效应.ppt
第三章有机化学中的电子效应和空间效应吸引电子能力(电负性较大)比氢原子强的原子或原子团(如—X、—OH、—NO2、—CN等)有吸电子的诱导效应(负的诱导效应),用-I表示,整个分子的电子云偏向取代基。诱导效应强弱变化规律:D.带正电荷的基团具有吸电子诱导效应,带负电荷的基团具有给电子诱导效应。分子在外界电场(试剂、溶剂、极性容器)的影响下,键的极性也发生一些改变,这种现象叫极化性。不同的共价键,对外界电场的影响有不同的感受能力,这种感受能力通常叫做可极化性。C—X键的极性:C—F>C—Cl>C—Br>C

高等有机化学电子效应 (2).ppt
第三章有机化学中的电子效应和空间效应吸引电子能力(电负性较大)比氢原子强的原子或原子团(如—X、—OH、—NO2、—CN等)有吸电子的诱导效应(负的诱导效应),用-I表示,整个分子的电子云偏向取代基。诱导效应强弱变化规律:D.带正电荷的基团具有吸电子诱导效应,带负电荷的基团具有给电子诱导效应。分子在外界电场(试剂、溶剂、极性容器)的影响下,键的极性也发生一些改变,这种现象叫极化性。不同的共价键,对外界电场的影响有不同的感受能力,这种感受能力通常叫做可极化性。C—X键的极性:C—F>C—Cl>C—Br>C
电子效应和溶剂效应专题培训课件.ppt
取代基效应3.传递有一定限度(短程传递),经过三个碳原子以后,已极微弱。例如-氯代辛酸二.诱导效应的相对强度2.通过分析NMR化学位移确定同周期:电负性随元素的族数增加,故-I效应自左至右增加。Eg.-I:-CR3<-NR2<-OR<-F同一族:元素电负性随周期数增高而递减,故-I效应自上而下降低。Eg.-I:-F>-Cl>-Br>-I;-OR>-SR带正电荷的基团比同类型的不带电荷的基团吸电子能力强得多;Eg.–I:-N+R3>-NR2与碳原子相连的原子,若是同种原子但饱和程度不同,则不饱和程度高的吸
