
课件-全国-2019_(江苏专用版)2020版高考化学总复习 专题六 第2讲 化学反应的方向和限度 化学平衡状态课件.pptx

淑然****by








亲,该文档总共57页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

课件-全国-2019_(江苏专用版)2020版高考化学总复习 专题六 第2讲 化学反应的方向和限度 化学平衡状态课件.pptx
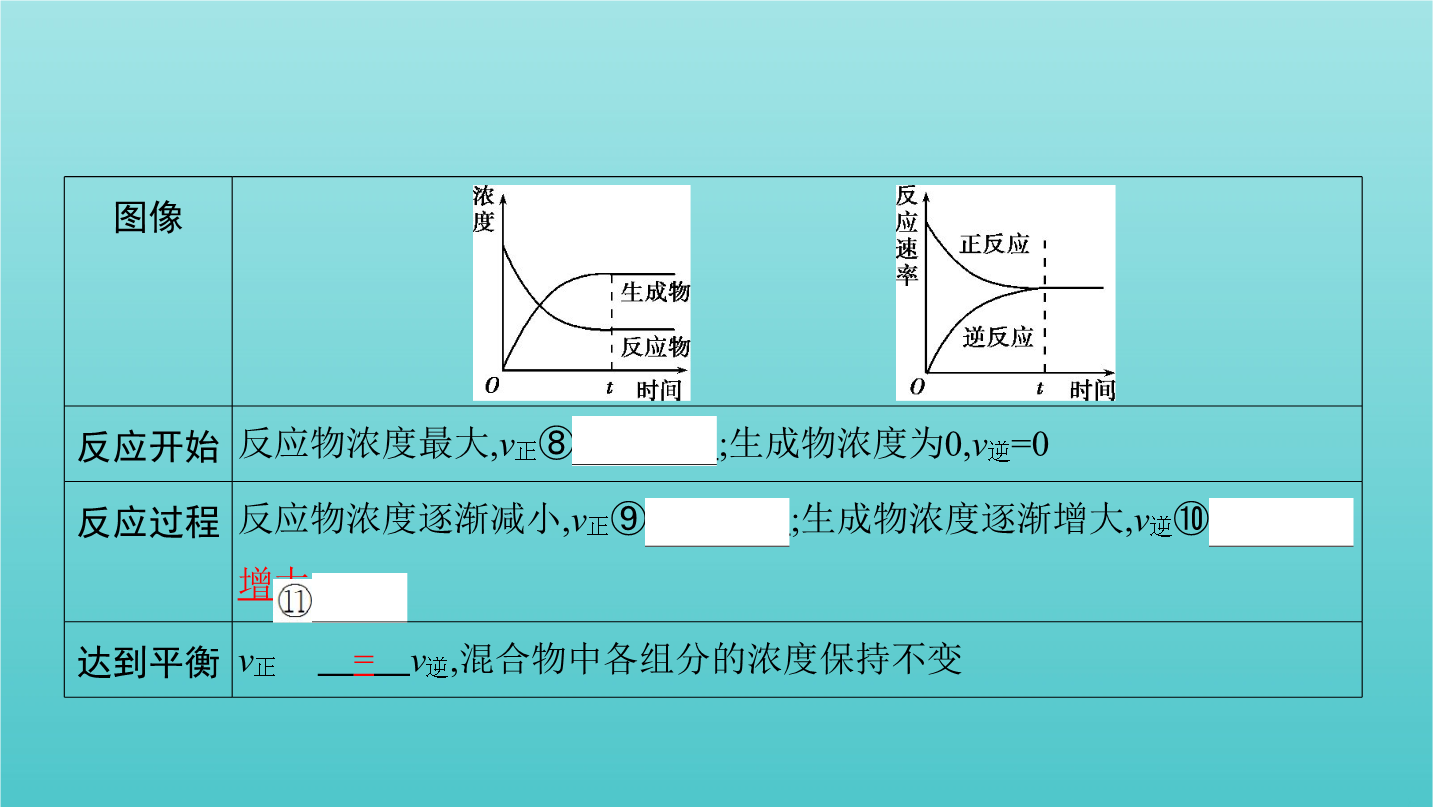
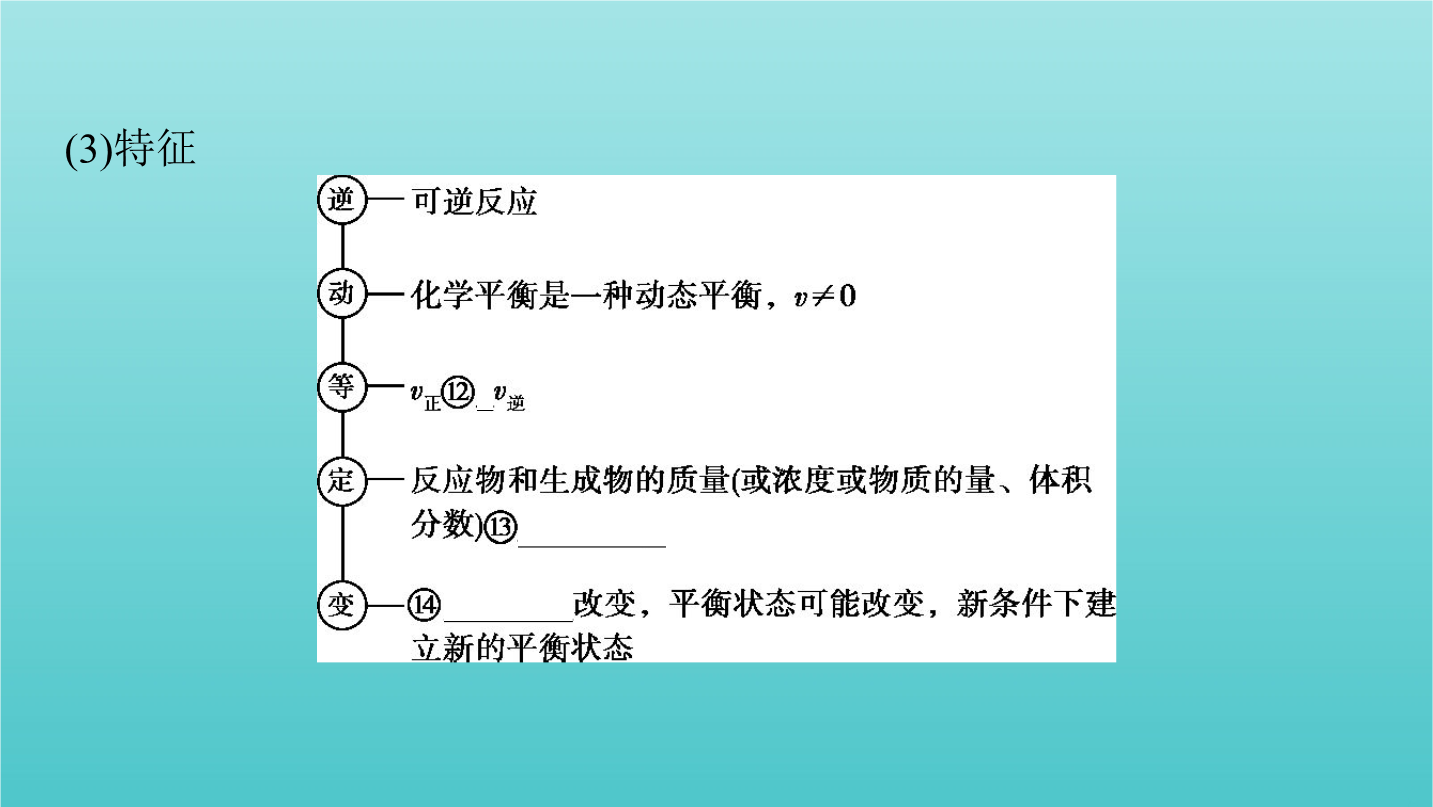
第2讲化学反应的方向和限度化学平衡状态考点一平衡标志与化学平衡常数考点一平衡标志与化学平衡常数2.化学平衡状态(1)概念:一定条件下的可逆反应中,正反应速率与逆反应速率⑥相等时,反应体系中所有参加反应的物质的⑦浓度保持不变的状态。(2)建立过程在一定条件下,把反应物加入到固定容积的密闭容器中,平衡的建立过程如下:图像(3)特征 特别提醒(1)化学反应的平衡状态可以从正反应方向建立,也可以从逆反应方向建立。(2)化学反应达到化学平衡状态时正、逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物

(江苏专用版)2020版高考化学总复习 专题六 第2讲 化学反应的方向和限度 化学平衡状态课件.pptx
第2讲化学反应的方向和限度化学平衡状态考点一平衡标志与化学平衡常数考点一平衡标志与化学平衡常数2.化学平衡状态(1)概念:一定条件下的可逆反应中,正反应速率与逆反应速率⑥相等时,反应体系中所有参加反应的物质的⑦浓度保持不变的状态。(2)建立过程在一定条件下,把反应物加入到固定容积的密闭容器中,平衡的建立过程如下:图像(3)特征 特别提醒(1)化学反应的平衡状态可以从正反应方向建立,也可以从逆反应方向建立。(2)化学反应达到化学平衡状态时正、逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物

(江苏专用版)高考化学总复习 专题六 第2讲 化学反应的方向和限度 化学平衡状态练习(含解析)-人教版高三全册化学试题.docx
第2讲化学反应的方向和限度化学平衡状态一、单项选择题1.下列叙述不正确的是()A.碳酸氢钠加热可以分解,因为升高温度利于熵增的方向自发进行B.在温度、压强一定的条件下,自发反应总是向ΔG=ΔH-TΔS<0的方向进行C.水结冰的过程不能自发进行的原因是此过程为熵减的过程,改变条件也不可能自发进行D.混乱度减小的吸热反应一定不能自发进行答案CH2O(l)H2O(s)ΔH<0,水结冰的反应符合焓判据,能自发进行,C项错误。2.在密闭容器中进行反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分

课件-全国-2019_(江苏专用)2020高考化学大一轮复习 专题7 第2讲 化学反应的方向和限度课件.pptx
第2讲化学反应的方向和限度考纲要求:1.了解化学反应的可逆性。(宏观辨识与微观探析)2.了解化学平衡的建立,掌握化学平衡的特征。(变化观念与平衡思想)3.了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算。(变化观念与平衡思想)4.能正确计算化学反应的转化率(α)。(证据推理与模型认知)-3--4--5--6--7--8--9--10--11--12--13--14--15--16--17--18--19--20--21--22--23--24--25--26--27--28--29--30--

课件-全国-2019_(江苏专用版)2020版高考化学总复习 专题六 第1讲 化学反应速率课件.pptx
第1讲化学反应速率考点一化学反应速率的概念及计算考点一化学反应速率的概念及计算 特别提醒(1)化学反应速率指的是一段时间内的平均速率而不是瞬时速率,且都取正值。(2)同一化学反应,相同条件下不同物质表示的反应速率,其数值可能不同,但表示的意义相同。3.化学反应速率与化学计量数的关系对于已知反应:mA(g)+nB(g) pC(g)+qD(g),在同一段时间内,用不同物质来表示该反应的化学反应速率,当单位相同时,化学反应速率的数值之比等于这些物质在化学方程式中的⑥化学计量数之比。即v(A)∶v(B)∶v(C)
