
课件-全国-2008_高三化学电化学复习ppt.rar

宏硕****mo








亲,该文档总共26页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

课件-全国-2008_高三化学电化学复习ppt.rar
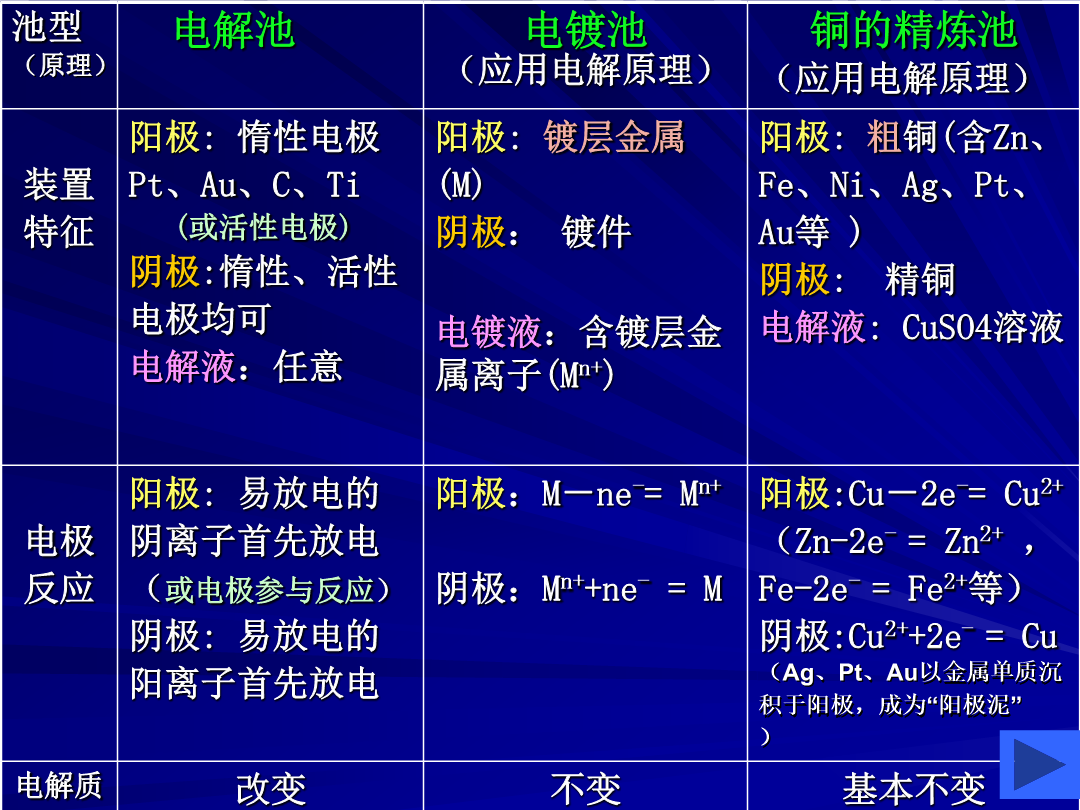
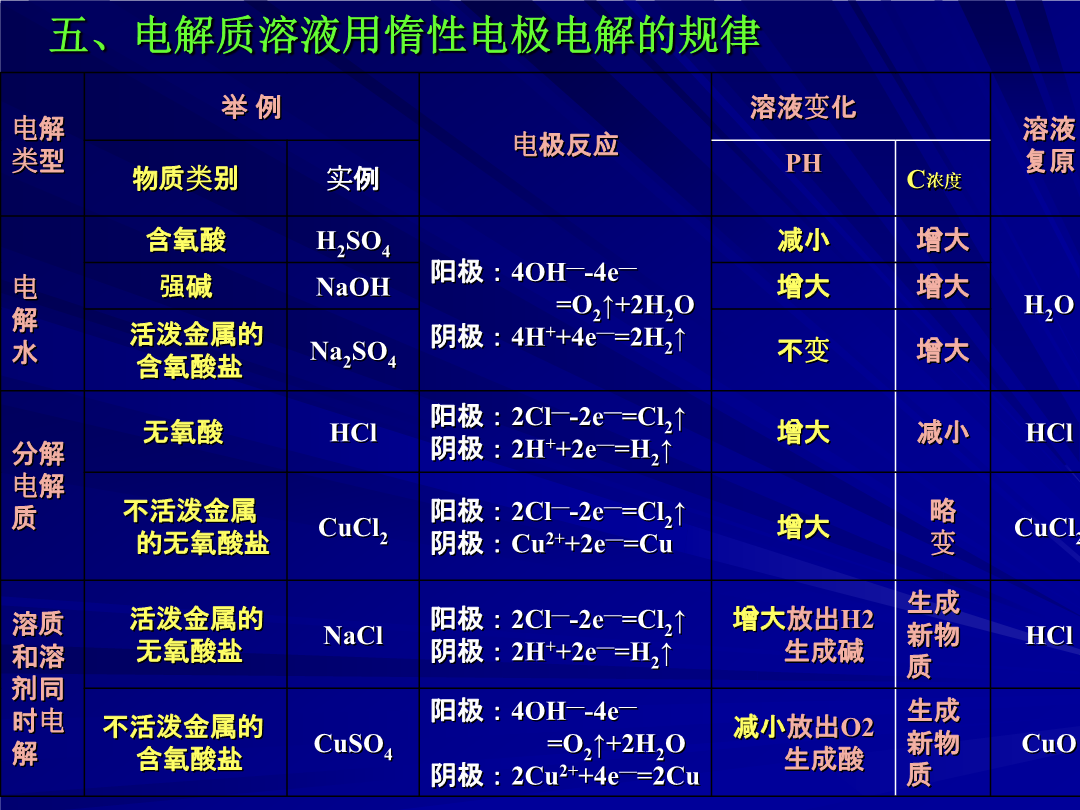
【学习目标】1、掌握原电池、电解池的概念及原理,了解铜的电解精炼、镀铜、氯碱工业反应原理2、学会电极的判断,学会正确书写电极反应及总反应方程式,掌握常见离子放电的规律;3、能运用得失电子守恒法解决电化学的相关计算。一、原电池、电解池工作原理池型(原理)常见阴阳离子放电顺序(离子浓度接近时)1.金属腐蚀:(1)化学腐蚀(2)电化腐蚀a.析氢腐蚀b.吸氧腐蚀2.防护方法:(1)改变金属内部组织结构(2)在金属表面覆盖保护(3)电化学保护法(牺牲阳极的阴极保护法)3.制造新化学电源:如太阳能电池、核电池、燃料电

课件-全国-2008_高三化学 电化学大学内容 ppt.rar
复习补充一:由电池反应设计电池补充二:求电池反应的平衡常数lnK=(nF/RT)E应用:计算弱电解质电离常数和难溶电解质溶度积浓差电池电池电动势测定的应用:电解质溶液平均活度系数和标准电极电势EΘ的测定;pH值的测定分解电压极化和超(过)电势浓差极化2.电化学极化(活化极化)(electrochemicalpolarization)定义:消除了浓差极化后,电极电势仍偏离平衡电极电势的现象。成因:电极过程的动力学障碍。——电解反应过程中某一步骤迟缓造成。示例:H+在阴极的放电。分

课件-全国-2008_高三化学 电化学平衡及其应用 ppt.rar
电化学平衡一、原电池1、氧化还原反应与原电池氧化还原反应有电子转移的化学反应——氧化还原反应。原电池能将氧化还原反应中的化学能转变为电能的装置。2、原电池的组成正极Cu2++2e=Cu电子(从外电路)流入原电池的一极。正极上总是发生还原反应,极板上是缺电子的,带正电荷。3、半电池及氧化还原电对*从原电池的构造来看,一个完整的原电池,由两个“半电池”所构成:1)铜板和硫酸铜;2)锌板和硫酸锌。为了书写的方便,常用下列符号来表示原电池的结构:(1)以(+)表示原电池的正极,正极总是写在右边;以(-)表示原

课件-全国-2008_高三化学电化学原理及其应用(高三复习).rar
电化学原理及其应用酒精溶液氯化钠溶液1.有活泼性不同的两个金属电极(或一种非金属导体如石墨)2.电极均插入电解质溶液中3.两极相连(或接触)形成闭合回路4.有一个能自发进行的氧化还原反应原电池化学能转变为电能原电池的工作原理三、原电池电极名称的判断四、金属腐蚀与防护五、电极反应式的书写总反应:CH4+2O2+2OH-=CO32-+3H2O稀H2SO4浓HNO35、银锌电池(钮扣式电池)的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为KOH溶液,总反应为:Ag2O+Zn=2Ag+Zn

课件-全国-2008_高三化学 电化学金属腐蚀 ppt.rar
第四章电化学金属腐蚀基本要求氧-还反应的实质**补充无机化学反应可分为两大类:一类是非氧化还原反应,如复分解反应、中和反应、盐类水解和某些配合反应等,这些反应的特点是反应物中原子或离子没有氧化数的变化;另一类是氧化还原反应,所有氧-还反应的共同特点是反应物中某些元素的氧化数发生了变化。一、氧化数的规定单质中,元素的氧化数为零,H2Cl2Fe正常氧化物中,O的氧化数为-2,过氧化物(H2O2、Na2O2)中O的氧化数为-1,KO2中O的氧化数为-0.5,KO3中O的氧化数为-1/3,OF2中O的氧化数为+2
