
课件-全国-2008_高一化学 第二节 化学计量在实验中的应用2 ppt.rar

书錦****by









亲,该文档总共26页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

课件-全国-2008_高一化学 化学计量在实验中的应用 ppt.rar
第二节化学计量在实验中的应用问题的提出:例:12克碳中含有多少个碳原子?一打一.物质的量-摩尔物质的量和摩尔物质的量n(单位mol)物质的量摩尔质量[例]4.9g硫酸里含有多少个硫酸分子?[练习]20.2g硝酸钾中,氧原子的质量是多少g?一、关于固体、液体物质的体积1mol各种固体、液体物质的体积:如:1molFe体积可通过如下途径求得:1molFe的质量为m(Fe)=56g其体积为V(Fe)=m(Fe)/ρ(Fe)=56g/7.8(g·cm-3)=7.2cm-3同样的方法可求出:1molFe的体积为7.

课件-全国-2008_高一化学 第二节 化学计量在实验中的应用2 ppt.rar
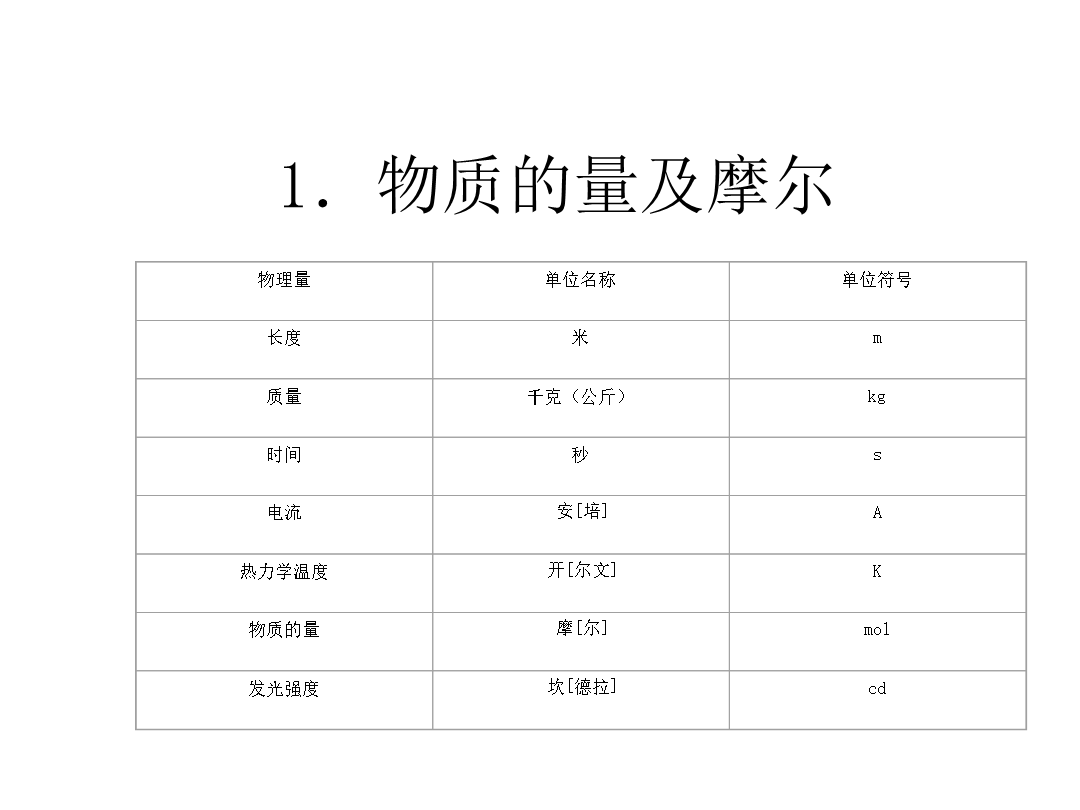
教学案例2:《物质的量、摩尔、摩尔质量》教学重点:2.过程与方法二、教学方式三、教学过程例如S+O2===SO2微观角度:1个硫原子1个氧分子1个SO2分子宏观角度:32g32g64g从上述方程式我们可以看到什么呢?[学生]看到反应物、生成物的数目和质量关系。那么我们就需要一个桥梁把宏观的质量和微观的粒子数联系起来,这个物理量就是物质的量。[教师]第14届国际计量大会通过以“物质的量”作为化学计量的基本单位量,至此,物质的量和长度、质量、时间等成为国际单位制中的7个基本单位。1.物质的量及摩尔老师:我们用

课件-全国-2008_高一化学 第二节 化学计量在实验中的应用1 ppt.rar
第二节化学计量在实验中的应用500g宏观物质资料卡片:国际单位制(SI)中的七个基本物理量一、物质的量碳原子6.02×1023意大利物理学家阿梅代奥·阿伏加德罗(A.Avogadro,1776-1856)趣味小知识6、注意事项通过阅读与思考你能否得出物质的量(n),阿伏加德罗常数(NA),与粒子数(N)的关系?计算与讨论:1mol几种物质的质量定义:单位物质的量的物质所具有的质量计算与提高根据以上问题能否得出物质的量(n),质量(m)与摩尔质量(M)三者之间的关系?[第一课时作业]4.下列说法不正确的是(

课件-全国-2008_高一化学 第二节 化学计量在实验中的应(物质的量与摩尔质量) ppt.rar
第二节化学计量在实验中的应用曹冲称象的故事1个O原子6.02×1023个H的质量6.02×1023个O一、物质的量:练习1:6.02×1023个H的“物质的量”是_____练习1:1molC中约含有————————个碳原子二、摩尔质量练习1:已知1.5mol某气体的质量是48g(1)求这种气体的摩尔质量(2)这种气体是_____A.CO2B.SO2C.O2D.NO练习2:(1)1.5molCl2的质量是___________(2)3molH2的质量是___________(3)2.5molO2的质量是__

课件-全国-2008_高一化学 化学实验(二) ppt.rar
化学实验——气体的实验室制法(二)1、气密性检查检验气密性的原理是把一定量的气体升温或压缩,使气压增大,液封的一端产生气泡或液面差,即证明气密性良好。常见的检验方法如下:方法:将导管出口插入水中,用手掌(或热毛巾或用酒精灯微热)捂住烧瓶,看水中的管口是否有气泡逸出,过一会儿移开手掌或毛巾,烧杯内的导管中有水上升形成水柱。说明装置不漏气。练习:请检查下面装置的气密性(2)带有长颈漏斗的气体发生装置的气密性检查练习:检查简易气体发生器的气密性(3)分段法用于较复杂的实验装置的气密性检验2、防倒吸装置(2)设置
