
学案-江苏-2018_江苏省如皋市白蒲镇2018届九年级化学下册 课题3 溶液的酸碱性复习学案(无答案)(新版)新人教版.doc

冷霜****魔王



在线预览结束,喜欢就下载吧,查找使用更方便
相关资料
学案-江苏-2018_江苏省如皋市白蒲镇2018届九年级化学下册 课题3 溶液的酸碱性复习学案(无答案)(新版)新人教版.doc
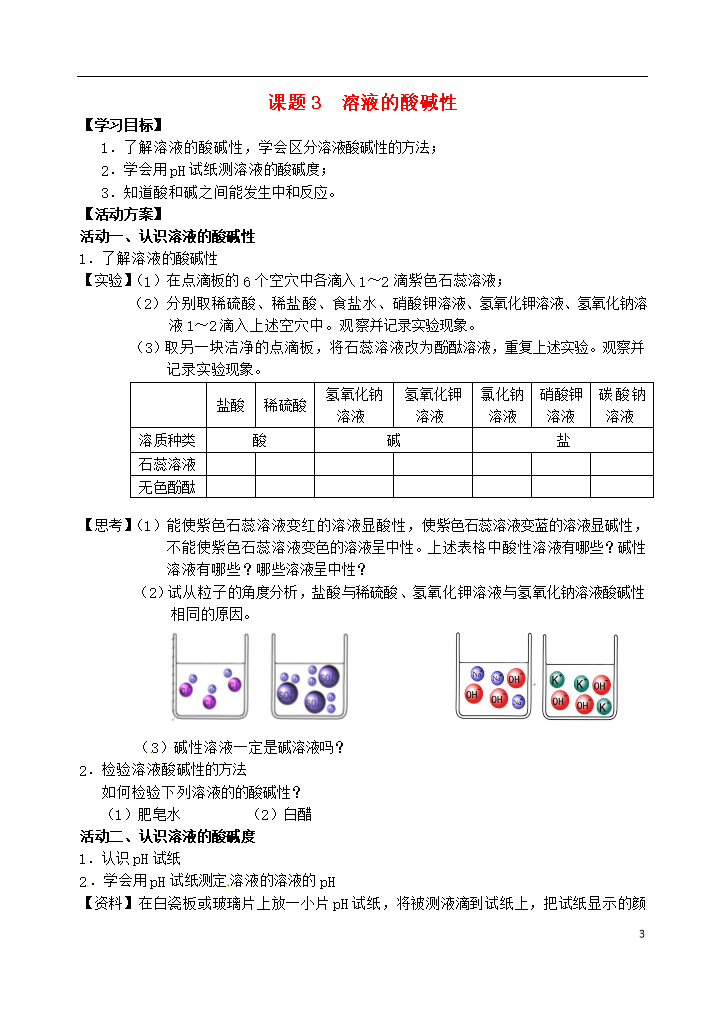
3课题3溶液的酸碱性【学习目标】1.了解溶液的酸碱性,学会区分溶液酸碱性的方法;2.学会用pH试纸测溶液的酸碱度;3.知道酸和碱之间能发生中和反应。【活动方案】活动一、认识溶液的酸碱性1.了解溶液的酸碱性【实验】(1)在点滴板的6个空穴中各滴入1~2滴紫色石蕊溶液;(2)分别取稀硫酸、稀盐酸、食盐水、硝酸钾溶液、氢氧化钾溶液、氢氧化钠溶液1~2滴入上述空穴中。观察并记录实验现象。(3)取另一块洁净的点滴板,将石蕊溶液改为酚酞溶液,重复上述实验。观察并记录实验现象。盐酸

学案-江苏-2018_江苏省如皋市白蒲镇2018届九年级化学下册 课题8 化学肥料复习学案(无答案)(新版)新人教版.doc
1课题8化学肥料【学习目标】1.了解常见化肥的种类和作用;2.认识化肥及农药对环境的影响,增强环境保护的意识;3.初步学会鉴别常见化肥(氮肥、磷肥、钾肥)的方法。【活动方案】活动一、了解常见化肥的种类和作用阅读课本P79~80的内容,回答下列问题:物质主要作用化肥类别钾肥化学式磷矿粉过磷酸钙氯化钾氯化铵氨水尿素碳酸氢铵硫酸钾硝酸钾提供磷元素,使植物根系发达,增强抗寒和抗旱的能力氮肥提供氮元素,使植物生长茂盛,叶色浓

学案-江苏-2018_江苏省如皋市白蒲镇2018届九年级化学下册 课题10 物质的鉴别复习学案(无答案)(新版)新人教版.doc
2课题10物质的鉴别【学习目标】1.学会从不同的角度选择鉴别试剂;2.了解鉴别题解题的思路与方法。【活动方案】活动一、学会从物质性质的角度选择鉴别试剂现有两瓶失去标签的无色溶液,分别为稀硫酸和饱和石灰水,如何将这两瓶溶液鉴别出来呢?1.组内说说稀硫酸、石灰水分别具有哪些化学性质?2.你能利用哪些物质将稀硫酸和石灰水区分开?说说你鉴别的依据。3.如果失去标签的两瓶无色溶液分别为稀硫酸和稀盐酸,如何鉴别呢?4.下列白色固体可用水进行区分,请阐述鉴别过程中可能观察
学案-江苏-2018_江苏省如皋市白蒲镇2018届九年级化学下册 课题1 认识酸碱盐复习学案(无答案)(新版)新人教版.doc
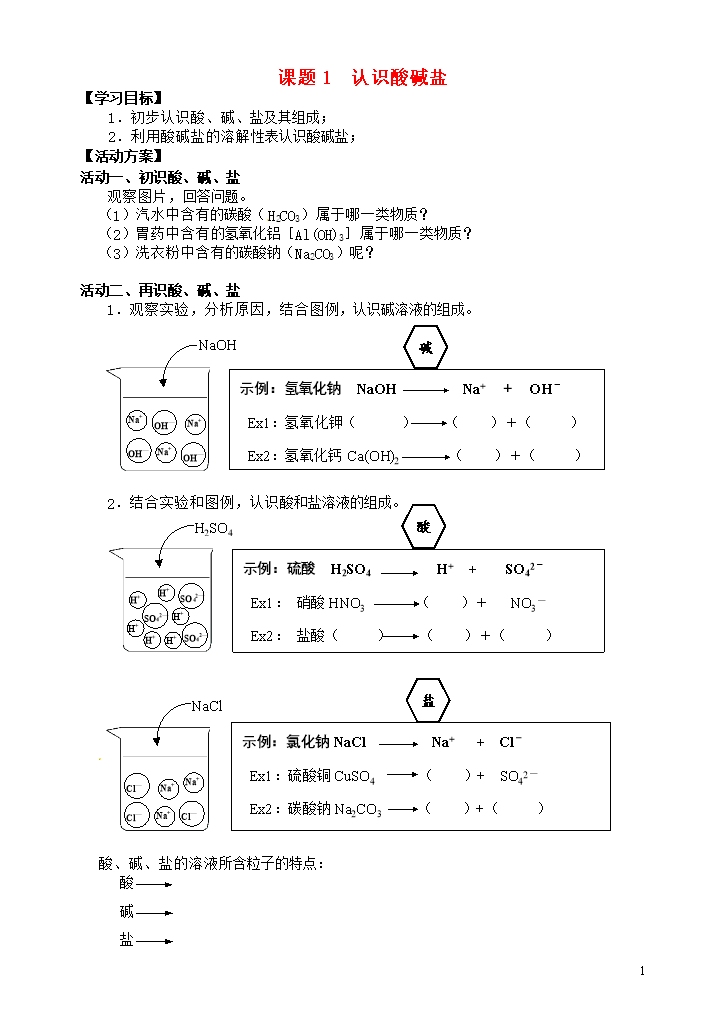
1课题1认识酸碱盐【学习目标】1.初步认识酸、碱、盐及其组成;2.利用酸碱盐的溶解性表认识酸碱盐;【活动方案】活动一、初识酸、碱、盐观察图片,回答问题。(1)汽水中含有的碳酸(H2CO3)属于哪一类物质?(2)胃药中含有的氢氧化铝[Al(OH)3]属于哪一类物质?(3)洗衣粉中含有的碳酸钠(Na2CO3)呢?活动二、再识酸、碱、盐1.观察实验,分析原因,结合图例,认识碱溶液的组成。OH—OH—OH—Na+Na+Na+示例:氢氧化钠NaOHNa++OH-

学案-江苏-2018_江苏省如皋市白蒲镇2018届九年级化学下册 课题12 推断题专题复习学案(无答案)(新版)新人教版.doc
1课题12推断题专题【教学目标】学会正确解推断题【活动方案】活动一、感知解题步骤阅读一道推断题的解题过程,完成相应问题:例1:A、B、C分别为盐、碱、酸的溶液。A溶液呈蓝色;在B、C溶液中滴入石蕊试液,分别呈蓝色和红色;将A、B溶液混合,得蓝色沉淀D和无色溶液E;将B、C溶液混合无现象,但得到E溶液,E由两种元素组成,且含钠元素。则A为BC。解题过程:⑴审清题意,寻找信息:(可在题目上将相应的信息用笔画出)读题后可找到下列信息:①A是蓝色溶液②石蕊在B、C溶液中分别会
