
2019届A版高考化学总复习专题六原子结构化学键讲义.ppt

王子****青蛙










亲,该文档总共20页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

2019届A版高考化学总复习专题六原子结构化学键讲义.ppt
专题六原子结构化学键一原子1.原子的组成原子2.质量数原子核中所有的质子和⑤中子的相对质量取近似整数值后相加之和称为质量数[即原子 X中:A(质量数)=Z(质子数)+N(中子数)]。二原子结构与元素性质的关系一般,金属元素原子的最外层电子数①小于4,在化学反应中易失去电子;非金属元素原子的最外层电子数②大于或等于4,在化学反应中易得到电子;稀有气体元素原子最外层电子数为8(氦为2),为稳定结构,在化学反应中既不易得到电子又不易失去电子。三原子核外电子排布1.电子层所表示的物理意义在含有多个电子的原子里,电

课件-全国-2018_(A版)2019版高考化学总复习 专题六 原子结构 化学键课件.ppt
专题六原子结构化学键一原子1.原子的组成原子2.质量数原子核中所有的质子和⑤中子的相对质量取近似整数值后相加之和称为质量数[即原子 X中:A(质量数)=Z(质子数)+N(中子数)]。二原子结构与元素性质的关系一般,金属元素原子的最外层电子数①小于4,在化学反应中易失去电子;非金属元素原子的最外层电子数②大于或等于4,在化学反应中易得到电子;稀有气体元素原子最外层电子数为8(氦为2),为稳定结构,在化学反应中既不易得到电子又不易失去电子。三原子核外电子排布1.电子层所表示的物理意义在含有多个电子的原子里,电

(A版)高考化学总复习 专题六 原子结构 化学键学案-人教版高三全册化学学案.doc
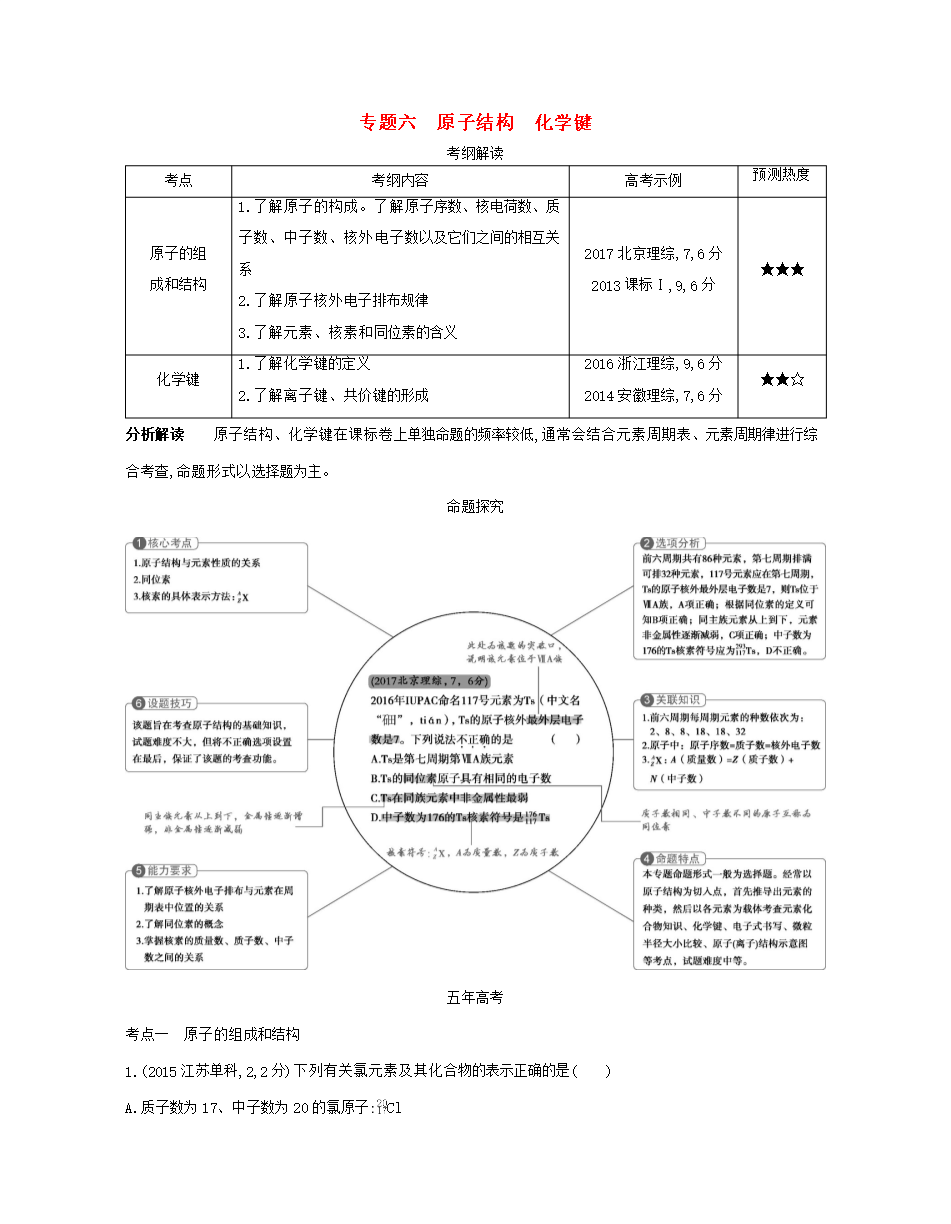
专题六原子结构化学键考纲解读考点考纲内容高考示例预测热度原子的组成和结构1.了解原子的构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系2.了解原子核外电子排布规律3.了解元素、核素和同位素的含义2017北京理综,7,6分2013课标Ⅰ,9,6分★★★化学键1.了解化学键的定义2.了解离子键、共价键的形成2016浙江理综,9,6分2014安徽理综,7,6分★★☆分析解读原子结构、化学键在课标卷上单独命题的频率较低,通常会结合元素周期表、元素周期律进行综合考查,命题形式以选择题为
(A版)高考化学总复习 专题六 原子结构 化学键学案-人教版高三全册化学学案.doc
专题六原子结构化学键考纲解读考点考纲内容高考示例预测热度原子的组成和结构1.了解原子的构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系2.了解原子核外电子排布规律3.了解元素、核素和同位素的含义2017北京理综76分2013课标Ⅰ96分★★★化学键1.了解化学键的定义2.了解离子键、共价键的形成2016浙江理综96分2014安徽理综76分★★☆分析解读原子结构、化学键在课标卷上单独命题的频率较低通常会结合元素周期表、元素周期律进行综合考查命题形式以选择题为主。命题

高考化学一轮总复习 专题五 原子结构 化学键课件.ppt
专题五原子结构化学键1.原子结构(1)原子的构成(2)微粒的关系①质子数=_________=___________=_________。②质量数=________+________。2.元素、核素、同位素(1)“三素”的概念(2)同位素的性质同一元素的各种核素的________不同________相同化学性质_______________物理性质_________。(3)几种重要的核素【助学技巧】原子结构的两个突破点(1)一个信息丰富的原子(或离子)符号(2)原子结构中的两个等量关
