
苏教版离子键离子晶体资料.ppt

YY****。。








亲,该文档总共60页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

苏教版离子键离子晶体资料.ppt
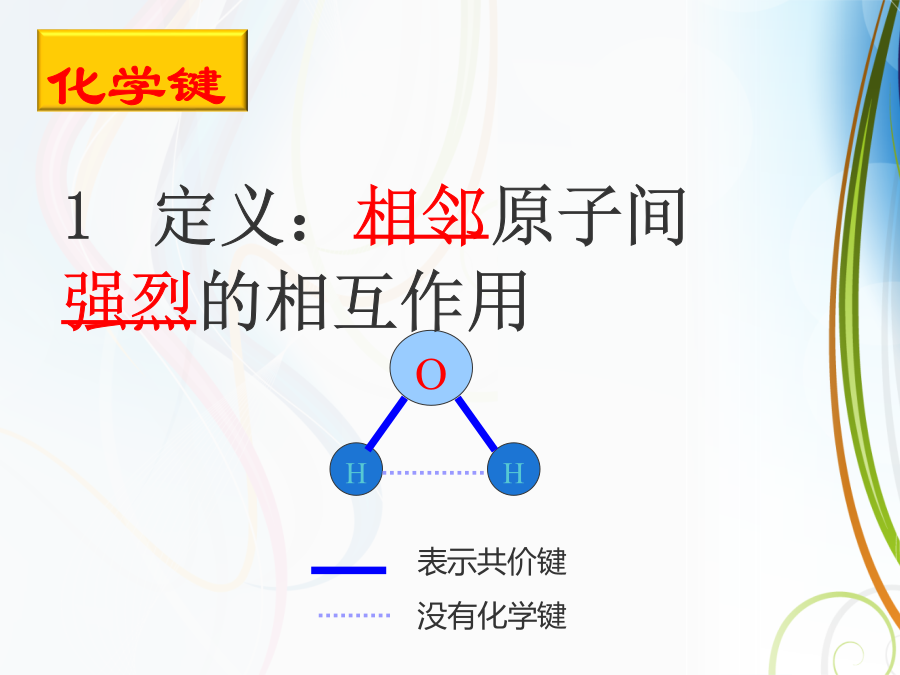
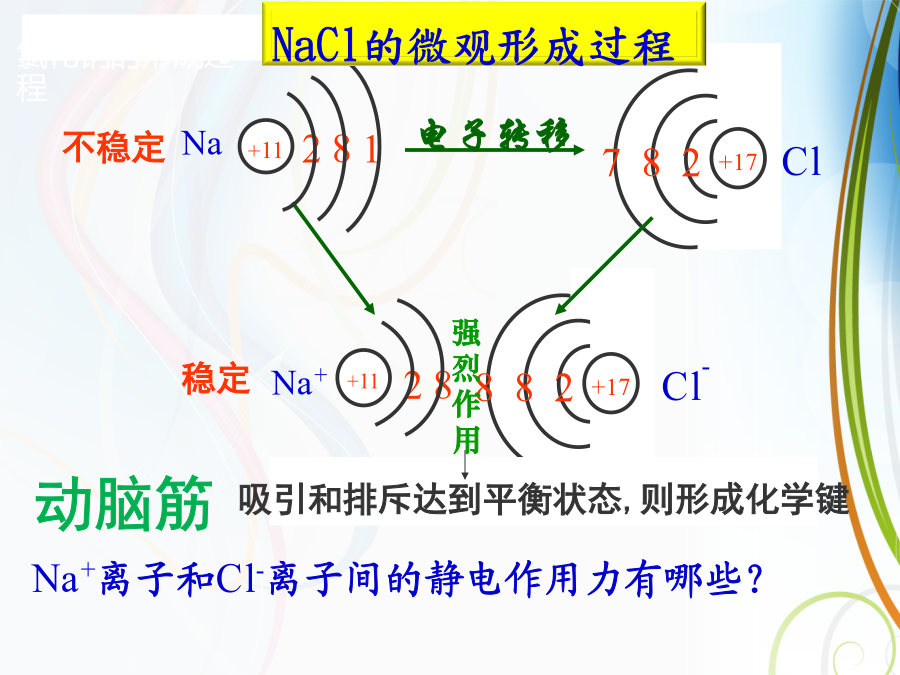
O2、用化学键的观点来分析化学反应的本质是什么?化学键1、金属钠在氯气中燃烧的现象是什么?2、钠原子与氯原子是如何结合成氯化钠的?你能用电子式表示氯化钠的形成过程吗?3、根据元素的金属性和非金属性差异,你知道哪些原子之间能形成离子键?电子得失形成阴、阳离子。一、离子键判断依据:二、用电子式表示离子键的形成过程·O·形象表示新的化学键形成的过程离子化合物电子式的书写:离子半径大小比较规律1、阳离子半径<相应的原子半径;如:Na+<Na2、阴离子半径>相应的原子半径;如:Cl->Cl3、同一主族元素,从上到下

高二化学离子键 离子晶体教案 苏教版.doc
高二化学离子键离子晶体教案【知识与技能】1、通过复习钠与氯形成氯化钠的过程,使学生理解离子键的概念、形成过程和特点。2、理解离子晶体的概念、构成及物理性质特征,掌握常见的离子晶体的类型及有关晶胞的计算。【过程与方法】复习离子的特征,氯化钠的形成过程,并在此基础上分析离子键的成键微粒和成键性质,培养学生知识迁移的能力和归纳总结的能力。在学习本节的过程中,可与物理学中静电力的计算相结合,晶体的计算与数学的立体几何、物理学的密度计算相结合。【情感态度与价值观】通过本节的学习,进一
离子键与离子晶体.ppt
離子鍵動畫:金屬與非金屬的浪漫婚禮氯化鈉的形成離子鍵的形成(NaCl為例)鈉與氯的反應氟化鈉的形成氯化鎂的形成陰、陽離子不斷靠近時,彼此間是否永遠只有吸引力?解:不是的,當陰、陽離子靠近時仍會出現兩離子間電子與電子、原子核與原子核間的斥力。典型元素形成離子典型元素形成離子時的電荷量1A族與7A族元素以離子鍵鍵結時,陽、陰離子各帶多少電荷呢?解:1A族形成+1價陽離子7A族形成-1價陰離子氫原子與其他元素化合時,若從其他元素獲得一個電子,氫也可以有與氦氣相同的電子排列。若氫以離子鍵與1A或2A族元素化合時,

离子键离子晶体.ppt
1、离子键的定义:使带相反电荷的阴、阳离子结合的相互(静电)作用静电作用指:在离子化合物中,阴、阳离子之间的静电引力使阴、阳离子相互吸引;阴离子的核外电子与阳离子的核外电子之间、阴离子的原子核与阳离子的原子核之间的静电斥力使阴、阳离子相互排斥。Na离子成键的主要原因:活泼金属最外层电子数少于4个,容易失去最外层电子而使次外层达到8个电子的稳定结构;活泼非金属最外层电子数多于4个,容易获得电子而使最外层达到8个电子的稳定结构。两者化合时,通过电子的转移形成结构相对稳定、电性相反的阴、阳离子,当阴、阳离子之间

《离子晶体——离子键、离子晶体》课时练习.doc
第四节离子晶体(1)离子键、离子晶体班级学号姓名1.关于晶体的下列说法正确的是()A.在晶体中只要有阴离子就一定有阳离子B.在晶体中只要有阳离子就一定有阴离子C.离子晶体的熔点一定比金属晶体的高D.分子晶体的熔点一定比金属晶体的低2.下列各对物质中,化学键类型和晶体类型完全相同的是()A.NaCl和NaOHB.Br2和H2C.CCl4和FeCl3D.CO2和SiO23.下列叙述正确的是()A.任何晶体中,若含有阳离子也一定含有阴离子B.离子晶体中可能含有共价键C.离子晶体中只含有离子键不含有共价键D.分子
