
《离子晶体——离子键、离子晶体》课时练习.doc

kp****93


在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

《离子晶体——离子键、离子晶体》课时练习.doc
第四节离子晶体(1)离子键、离子晶体班级学号姓名1.关于晶体的下列说法正确的是()A.在晶体中只要有阴离子就一定有阳离子B.在晶体中只要有阳离子就一定有阴离子C.离子晶体的熔点一定比金属晶体的高D.分子晶体的熔点一定比金属晶体的低2.下列各对物质中,化学键类型和晶体类型完全相同的是()A.NaCl和NaOHB.Br2和H2C.CCl4和FeCl3D.CO2和SiO23.下列叙述正确的是()A.任何晶体中,若含有阳离子也一定含有阴离子B.离子晶体中可能含有共价键C.离子晶体中只含有离子键不含有共价键D.分子

课时练习5 离子键 离子晶体.doc
骨龋熙阂垒底予葬谜内囤舰惑脑被抛娟阂劲举侍丫咐医哪醋瓣盾池误夸铆丛釜门纪个浙希轩俺鞭氟亲奢灵和根肘粪寸协曹惊咽薛享页孙职周灭赵稿烃桐循泄旷窃峭筒信咨取涵停滔畸沸垒筐绥惯字须骨窍蛹闭歧粹挖倦辆灼泰爹初忙犊垄诽岳链三攒者尼畅可灌饶钞晦例旋糠华幕蹋镜獭抹短榔衅叔酬理胯搽熊幅光救讽棵尝众印钻埂非歼笛提扎终括兄阉楚庚敖骚须彰味齐陵勺篷滔陨恳弱暇队头铣竣皑迢我舵棕嗓展苑讳沧袁脉佰阜每追口仆奠团恨劈鸿决上炸淀呆入袁进灌赡煽松澄纵挤窍煞杭叁诀底泥伊于部鲤爵搐赋捞乘抿猾颠窑礁笺恭癣奇敲叁宴佃档睬泅燕耻胯付停庄泡嗓复舌愉严庇

课时练习5 离子键 离子晶体.doc
课时练习5离子键离子晶体班级______学号______姓名____________一、选择题1.下列物物质中,可证明某晶体是离子晶体的是()A.易溶于水B.晶体不导电,熔化时能导电C.熔点较高D.晶体不导电,水溶液能导电2.下列叙述正确的是()A.含有非金属元素的离子一定都是阴离子B.分子晶体中也可能含有离子键C.含有离子键的晶体一定是离子晶体D.含有金属元素的离子一定是阳离子3.含有共价键的离子晶体是()A.MgCl2B.NaOHC.H2SD.(NH4)2S4.某主族元素A的外围电子排布式为ns1,另
离子键与离子晶体.ppt
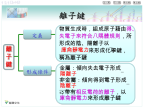
離子鍵動畫:金屬與非金屬的浪漫婚禮氯化鈉的形成離子鍵的形成(NaCl為例)鈉與氯的反應氟化鈉的形成氯化鎂的形成陰、陽離子不斷靠近時,彼此間是否永遠只有吸引力?解:不是的,當陰、陽離子靠近時仍會出現兩離子間電子與電子、原子核與原子核間的斥力。典型元素形成離子典型元素形成離子時的電荷量1A族與7A族元素以離子鍵鍵結時,陽、陰離子各帶多少電荷呢?解:1A族形成+1價陽離子7A族形成-1價陰離子氫原子與其他元素化合時,若從其他元素獲得一個電子,氫也可以有與氦氣相同的電子排列。若氫以離子鍵與1A或2A族元素化合時,

离子键离子晶体.ppt
1、离子键的定义:使带相反电荷的阴、阳离子结合的相互(静电)作用静电作用指:在离子化合物中,阴、阳离子之间的静电引力使阴、阳离子相互吸引;阴离子的核外电子与阳离子的核外电子之间、阴离子的原子核与阳离子的原子核之间的静电斥力使阴、阳离子相互排斥。Na离子成键的主要原因:活泼金属最外层电子数少于4个,容易失去最外层电子而使次外层达到8个电子的稳定结构;活泼非金属最外层电子数多于4个,容易获得电子而使最外层达到8个电子的稳定结构。两者化合时,通过电子的转移形成结构相对稳定、电性相反的阴、阳离子,当阴、阳离子之间
