
初中化学 第九单元 溶液 复习学案(二)人教版.doc

美丽****ka







在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

初中化学 第九单元 溶液 复习学案(二)人教版.doc
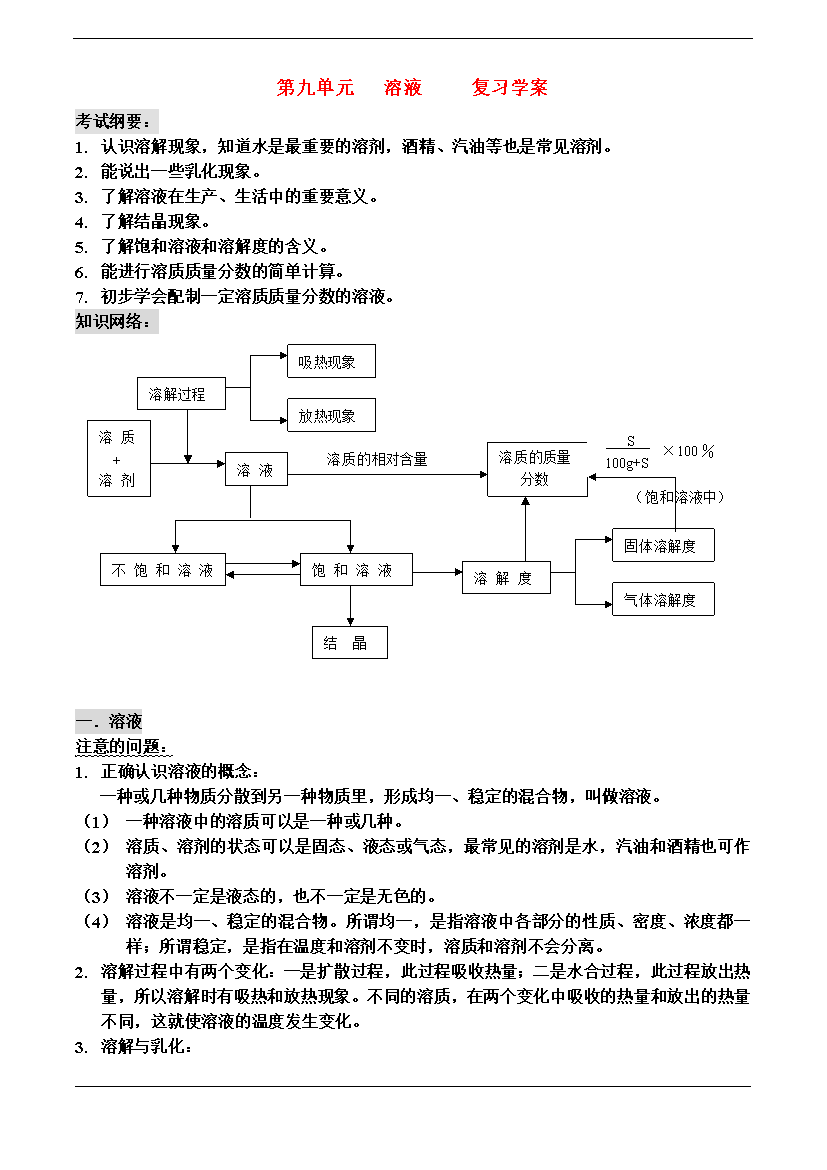
第九单元溶液复习学案考试纲要:认识溶解现象,知道水是最重要的溶剂,酒精、汽油等也是常见溶剂。能说出一些乳化现象。了解溶液在生产、生活中的重要意义。了解结晶现象。了解饱和溶液和溶解度的含义。能进行溶质质量分数的简单计算。初步学会配制一定溶质质量分数的溶液。知识网络:吸热现象溶解过程放热现象S100g+S×100%饱和溶液中溶质+溶剂溶质的质量分数溶质的相对含量溶液(饱和溶液中)固体溶解度饱和溶液不饱和溶液气体溶解度溶解度结晶一.溶液注意的问题:正确认识溶液的概念:一种或几种物质分散到另一种物质里,形成均一、
学案-全国-2010_初中化学 第九单元 溶液 复习学案(二)人教版.rar
第九单元溶液复习学案考试纲要:认识溶解现象,知道水是最重要的溶剂,酒精、汽油等也是常见溶剂。能说出一些乳化现象。了解溶液在生产、生活中的重要意义。了解结晶现象。了解饱和溶液和溶解度的含义。能进行溶质质量分数的简单计算。初步学会配制一定溶质质量分数的溶液。知识网络:吸热现象溶解过程放热现象S100g+S×100%饱和溶液中溶质+溶剂溶质的质量分数溶质的相对含量溶液(饱和溶液中)固体溶解度饱和溶液不饱和溶液气体溶解度溶解度结晶

人教版初中化学 第九单元溶液导学案(无答案).doc
初级中学九年级化学导学案课题:第九单元课型:新授课时间:2019年2月主备:吕园审核:班级:学生学案教师导案溶液的形成第一课时学习目标1.认识溶解现象建立溶液的概念并认识溶液、溶质、溶剂三者的关系;(重点和难点)2.理解溶解的过程认识溶液的基本特征;(重点和难点)3.知道溶液在科研、生产和生活中有重要应用。学习方法实验讨论总结课前预习1.海水是纯净物还是

初中化学 第九单元 溶液第 复习练习(一)人教版.doc
第九单元溶液复习学案课堂练习1.下列说法正确的是()A.均一、稳定的液体都是溶液B.溶液一定是无色、透明的液体C.一瓶蔗糖溶液中各部分的性质完全相同D.溶质可以有三种状态固态、液态、气态但溶剂只能是水2.下列液体属于溶液的是()A.酒精B.植物油、水、洗洁精混合振荡后的液体C.盐酸D.豆浆3.如图向装有水的试管中加入某种不与水发生化学反应的物质后U型管内的红墨水出现左低右高的现象则

人教版初中化学导学案:9.5_溶液_单元复习.doc
9.5《溶液》单元复习一、复习目标:1.掌握溶质、溶剂的概念,认识溶液的基本特征,掌握溶液的概念。2.理解饱和溶液和不饱和溶液的概念及相互转变,了解饱和溶液、不饱和溶液与浓溶液、稀溶液的区别与其相互关系。3.理解溶解度的概念,了解溶解度曲线的意义,了解气体溶解度与温度、压强的关系。4.掌握溶质的质量分数的概念、表示方法及有关计算,学会配制一定溶质质量分数的溶液。【温故知新】知识点一:溶液概念:分散到里,形成就是溶液。特征:性;性。溶质概念:叫做溶质。组成状态:态、态、态。溶剂概念:叫做溶剂。水是常用的溶剂
