
第三节物质的溶解性.pptx

xf****65









亲,该文档总共25页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

第三节物质的溶解性.docx
鲁教版五四制九年级第一单元溶液第三节物质的溶解性评测练习1.判断正误(1)向100g水里加入36gNaCl刚好达到饱和状态,所以NaCl的溶解度是36g。(2)20℃时,50g水中最多溶有18gNaCl,所以20℃时NaCl中的溶解度是18g.(3)20℃时,100gNaCl饱和溶液中含有NaCl26.5g,则20℃时NaCl的溶解度为26.5g。(4)20℃时,30gNaCl完全溶解于100g水里,所以20℃时NaCl的溶解度是30g。(5)20℃时,100g水里最多溶解36gNaCl,所以20℃时Na

第三节物质的溶解性.pptx
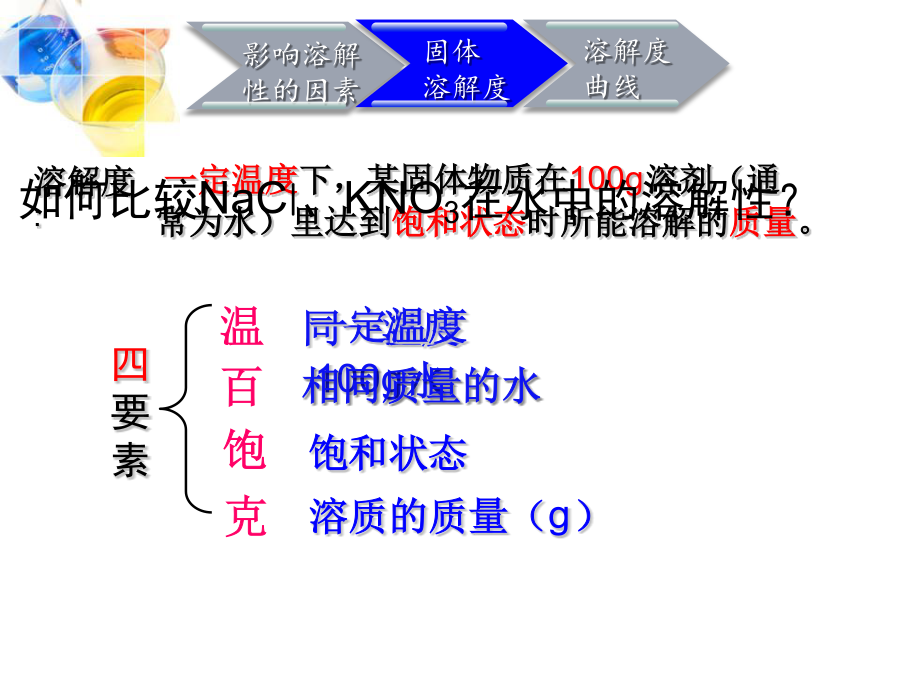
第一单元溶液1、了解溶解性的概念及影响固体物质溶解性的因素。2、通过对影响固体物质溶解性因素的实验探究,学会采用控制变量法设计实验方案,培养学生分析问题与解决问题的能力。3、理解溶解度的概念及其含义,学会运用溶解度来描述不同物质的溶解性。4、初步认识溶解度曲线,并能从中获得有关信息。同一温度“20℃时NaCl的溶解度为36g”表示什么意义呢?1、向100g水里加入36gNaCl刚好达到饱和状态,所以NaCl的溶解度是36g。2、20℃时,50g水中最多溶18gNaCl,所以20℃时NaCl的溶解度是18g

第三节物质的溶解性.doc
第三节物质的溶解性(第二课时)教学案——物质的溶解性的定量表示课型:新授课主备:李朝亮审核:司徒中学化学备课组【重点难点】理解溶解度的涵义,使用溶解度曲线解决问题。【知识准备】1物质的溶解性是指2、影响物质溶解性的因素:影响物质溶解性的因素举例1、溶质性质2、3、3、饱和溶液是指,不饱和溶液是指;要使一瓶接近饱和的硝酸钾溶液变成饱和溶液,可使用的方法有①②③。【教学过程】【师生互动】【问题情境引入】我们通过前面的学习已经知道食盐和蔗糖都易溶于水,那么他们在水中的溶解性那个强呢?能不能定量表示呢?打个比方,

第三节物质的溶解性.ppt
例题、黄铜是铜和锌的合金,为了测定某黄铜样品中铜的质量分数,取10g该黄铜样品加入到100g稀硫酸中,恰好完全反应,产生氢气0.1g。试求:(1)黄铜样品中铜的质量分数。(2)稀硫酸中溶质的质量分数。32.5g锌粒与1.30g/cm3的硫酸溶液100mL恰好完全反应来制取氢气。计算:(1)生成氢气的质量;练习、称取10克碳酸钙放入盛有73克稀盐酸的烧杯中,恰好完全反应。计算:(1)生成二氧化碳多少克?(2)该稀盐酸中溶质的质量分数.(3)反应后所得溶液的溶质质量分数。称取12.5克石灰石放入盛有73克稀盐

第三节物质的溶解性.ppt
例题、黄铜是铜和锌的合金,为了测定某黄铜样品中铜的质量分数,取10g该黄铜样品加入到100g稀硫酸中,恰好完全反应,产生氢气0.1g。试求:(1)黄铜样品中铜的质量分数。(2)稀硫酸中溶质的质量分数。32.5g锌粒与1.30g/cm3的硫酸溶液100mL恰好完全反应来制取氢气。计算:(1)生成氢气的质量;练习、称取10克碳酸钙放入盛有73克稀盐酸的烧杯中,恰好完全反应。计算:(1)生成二氧化碳多少克?(2)该稀盐酸中溶质的质量分数.(3)反应后所得溶液的溶质质量分数。称取12.5克石灰石放入盛有73克稀盐
