
NF-κB信号通路.ppt

lj****88







亲,该文档总共59页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

NF-κB信号通路.ppt
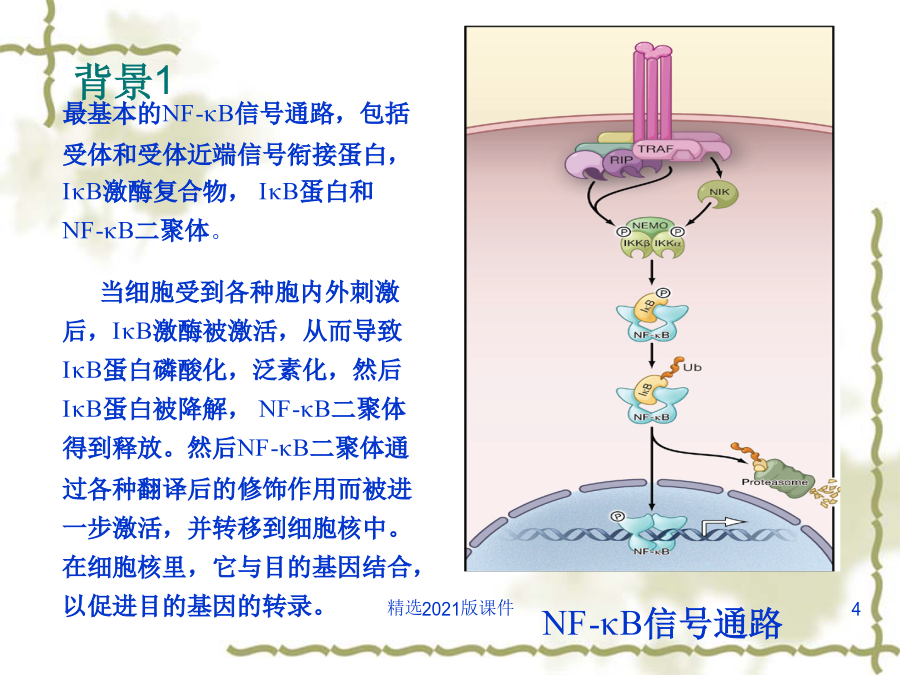
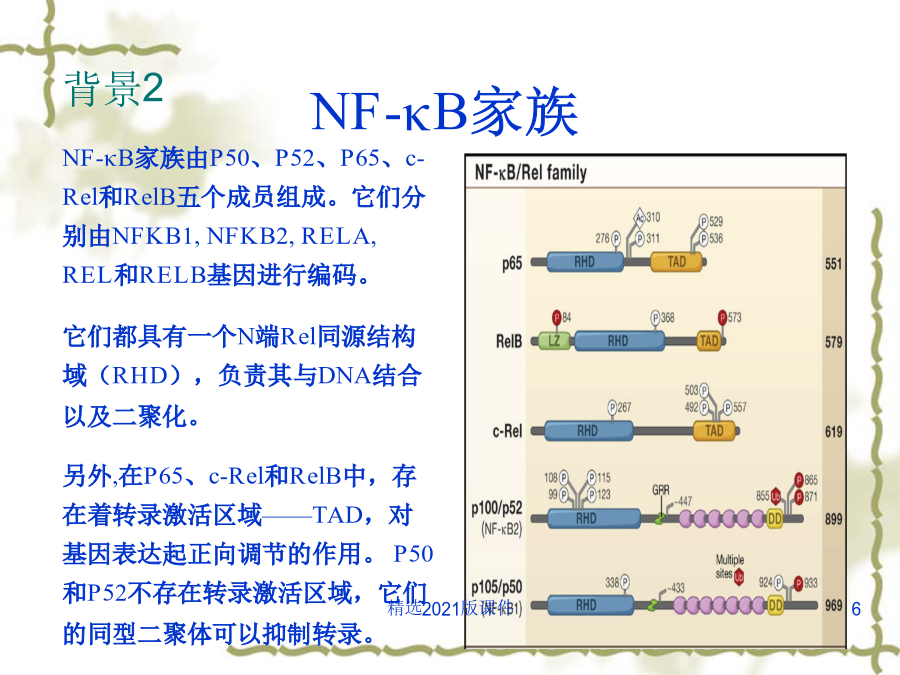
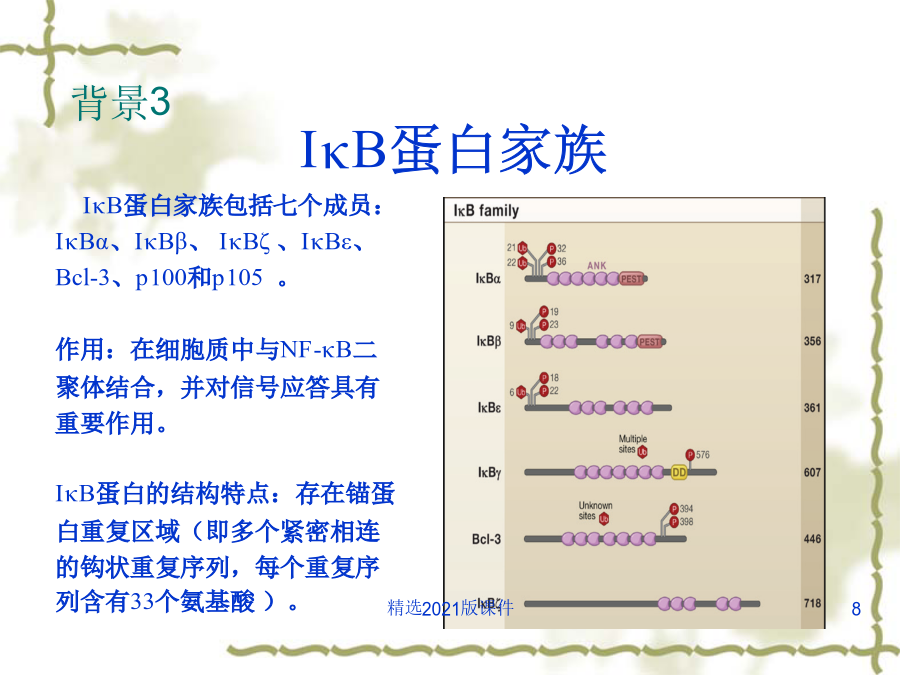
文献综述主要内容一.背景介绍背景1NF-κB经典和非经典通路NF-κB家族NF-κB二聚体的存在方式背景3背景4背景5很多胞外刺激信号都可以引起NF-κB信号通路的激活,如:促炎症细胞因子TNF-α、白介素IL-1,细菌脂多糖(LPS),T细胞及B细胞有丝分裂原,病毒双链RNA以及各种物理和化学压力等。虽然这些胞外刺激所产生的胞内早期信号途径各不相同,但一般认为,大多数此类胞外刺激起始的信号传递反应将最终激活IKK复合物。在这个传递过程中,衔接蛋白起着重要的作用。在很多NF-κB信号通路中,许多的信号中间

NF-κB信号通路.ppt
文献综述主要内容一.背景介绍背景1NF-κB经典和非经典通路NF-κB家族NF-κB二聚体的存在方式背景3背景4背景5很多胞外刺激信号都可以引起NF-κB信号通路的激活如:促炎症细胞因子TNF-α、白介素IL-1细菌脂多糖(LPS)T细胞及B细胞有丝分裂原病毒双链RNA以及各种物理和化学压力等。虽然这些胞外刺激所产生的胞内早期信号途径各不相同但一般认为大多数此类胞外刺激起始的信号传递反应将最终激活IKK复合物。在这个传递过程中衔接蛋白起着重要的作用。

NF-κB信号通路.ppt
文献综述主要内容一.背景介绍背景1NF-κB经典和非经典通路NF-κB家族NF-κB二聚体的存在方式背景3背景4背景5很多胞外刺激信号都可以引起NF-κB信号通路的激活,如:促炎症细胞因子TNF-α、白介素IL-1,细菌脂多糖(LPS),T细胞及B细胞有丝分裂原,病毒双链RNA以及各种物理和化学压力等。虽然这些胞外刺激所产生的胞内早期信号途径各不相同,但一般认为,大多数此类胞外刺激起始的信号传递反应将最终激活IKK复合物。在这个传递过程中,衔接蛋白起着重要的作用。在很多NF-κB信号通路中,许多的信号中间

NF-κB信号通路.ppt
文献综述主要内容一.背景介绍背景1NF-κB经典和非经典通路NF-κB家族NF-κB二聚体的存在方式背景3背景4背景5很多胞外刺激信号都可以引起NF-κB信号通路的激活,如:促炎症细胞因子TNF-α、白介素IL-1,细菌脂多糖(LPS),T细胞及B细胞有丝分裂原,病毒双链RNA以及各种物理和化学压力等。虽然这些胞外刺激所产生的胞内早期信号途径各不相同,但一般认为,大多数此类胞外刺激起始的信号传递反应将最终激活IKK复合物。在这个传递过程中,衔接蛋白起着重要的作用。在很多NF-κB信号通路中,许多的信号中间

NF-κB信号通路0.ppt
文献综述主要内容一.背景介绍背景1NF-κB经典和非经典通路NF-κB家族NF-κB二聚体的存在方式背景3背景4背景5很多胞外刺激信号都可以引起NF-κB信号通路的激活,如:促炎症细胞因子TNF-α、白介素IL-1,细菌脂多糖(LPS),T细胞及B细胞有丝分裂原,病毒双链RNA以及各种物理和化学压力等。虽然这些胞外刺激所产生的胞内早期信号途径各不相同,但一般认为,大多数此类胞外刺激起始的信号传递反应将最终激活IKK复合物。在这个传递过程中,衔接蛋白起着重要的作用。在很多NF-κB信号通路中,许多的信号中间
