
分子晶体与原子晶体ppt课件.ppt

天马****23





亲,该文档总共34页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

分子晶体与原子晶体ppt课件.ppt
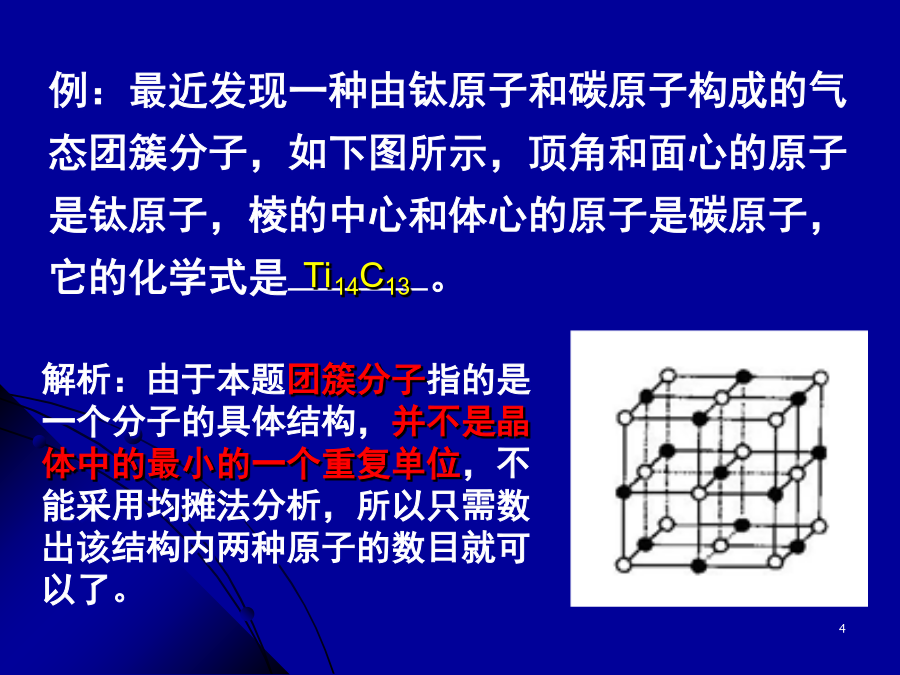
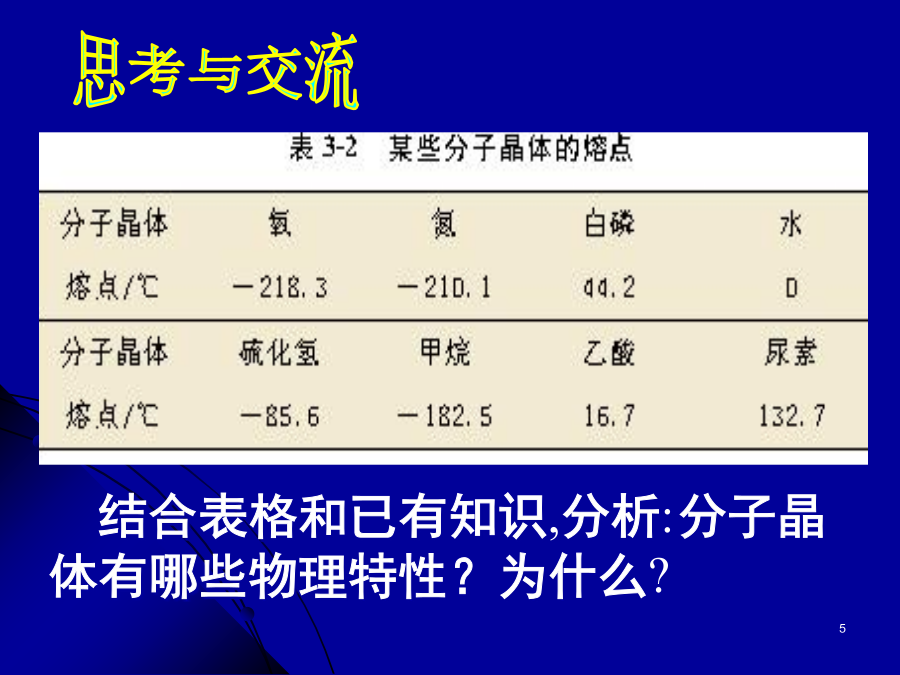
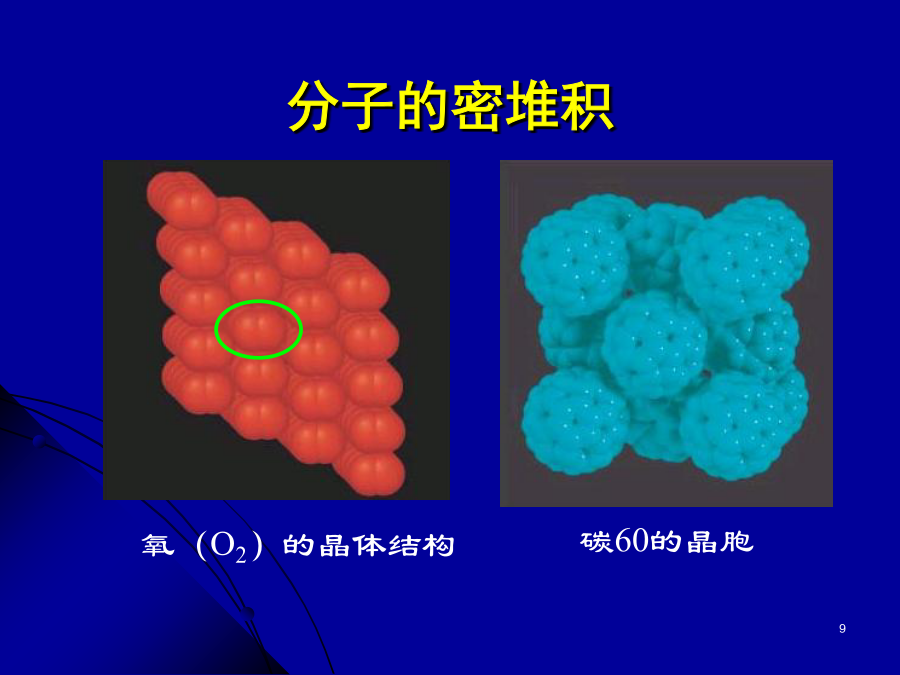
第二节分子晶体碘晶体结构一、分子晶体例:最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是。结合表格和已有知识,分析:分子晶体有哪些物理特性?为什么?4、物理特性:5、典型的分子晶体:6、分子晶体结构特征分子的密堆积冰中1个水分子周围有4个水分子干冰许多气体可以与水形成水合物晶体。最早发现这类水合物晶体的是19世纪初的英国化学家戴维,他发现氯可形成化学式为Cl2·8H20的水合物晶体。20世纪末,科学家发现海底存在大量天然气水合

分子晶体与原子晶体 PPT课件.ppt
第三节原子晶体与分子晶体【目标引领】通过了解晶体金刚石的宏观性质,理解原子晶体的空间结构特点,认识由共价键构成的晶体与其性质间的关系。【学习重点】掌握典型原子晶体结构特点与性质。【学习难点】了解金刚石和晶体二氧化硅的结构自学探究一答案:1、相邻原子、共价键、空间网状2、(1)方向性、饱和性、有限、不符合(2)共价键、不存在3、金刚石、晶体硅、金刚砂、水晶(1)SP3、4共价键、空间网状、109.50、0.154nm、347KJ/mol、共价键、非常大、很高、很大、十分稳定(2)硅原子、氧原子、原子、四、四

分子晶体原子晶体完整ppt课件.ppt
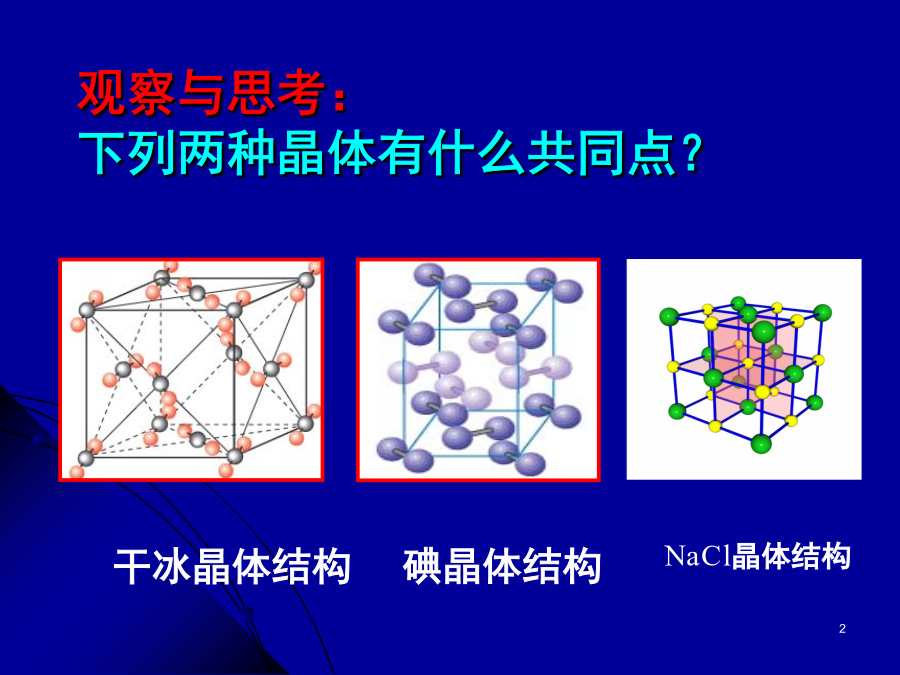
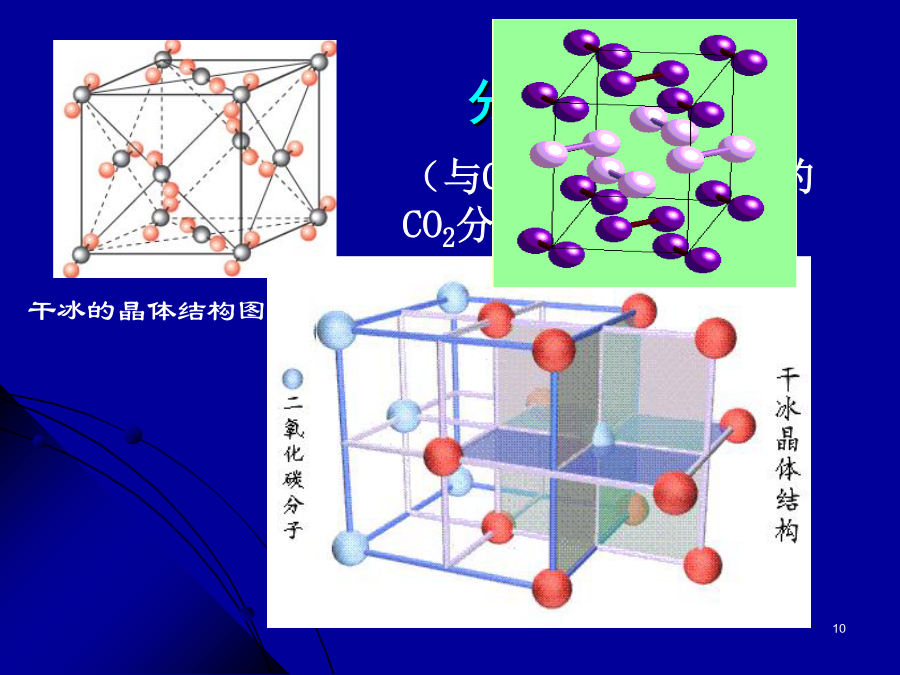
复习:1、晶体与非晶体有什么不同?2、什么叫晶胞?如何计算立方晶胞中微粒的数目?3、氯化钠晶胞如图所示一个晶胞中有几个Na+,几个Cl-?4、碘晶胞结构如图所示,问一个碘晶中有几个碘分子?3.2分子晶体和原子晶体一.分子晶体2.常见的分子晶体干冰的晶体结构图(2)有分子间氢键(如:HF、冰、NH3)--不具有分子密堆积特征冰中1个水分子周围有4个水分子分子晶体溶于水时,水溶液有的能导电,如HCl溶于水,有的不导电,如C2H5OH溶于水。2、怎样判断分子晶体的溶解性?3、分子晶体有哪些物理特性,为什么?由于

分子晶体原子晶体精ppt课件.ppt
复习:1、晶体与非晶体有什么不同?2、什么叫晶胞?如何计算立方晶胞中微粒的数目?3、氯化钠晶胞如图所示一个晶胞中有几个Na+,几个Cl-?4、碘晶胞结构如图所示,问一个碘晶中有几个碘分子?3.2分子晶体和原子晶体一.分子晶体2.常见的分子晶体干冰的晶体结构图(2)有分子间氢键(如:HF、冰、NH3)--不具有分子密堆积特征冰中1个水分子周围有4个水分子分子晶体溶于水时,水溶液有的能导电,如HCl溶于水,有的不导电,如C2H5OH溶于水。2、怎样判断分子晶体的溶解性?3、分子晶体有哪些物理特性,为什么?由于

分子晶体和原子晶体ppt课件.ppt
第三节原子晶体和分子晶体思考1二氧化硅的晶体结构思考2:金刚石的结构特征①、C采取什么杂化方式?②、每个碳原子周围紧邻的碳原子有多少个?每个C成几个键?③、形成怎样的空间结构?④、键角度数⑤、最小碳环由多少个碳原子组成?它们是否在同一平面内?⑥、C原子个数与C—C键数之比为多少?⑦、12克金刚石中C—C键数为多少NA?109º28´一、原子晶体硅晶体结构180º思考3:在二氧化硅的晶体结构中,最小的环由几个原子构成?1molSiO2中含几molSi—O键常见的原子晶体某些非金属单质:金刚石(C)、晶体硅(
