
(浙江版)高考化学一轮复习 专题六 化学能与电能的转化精练(含解析)-浙江版高三全册化学试题.docx

书生****aa










亲,该文档总共32页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

(浙江版)高考化学一轮复习 专题六 化学能与电能的转化精练(含解析)-浙江版高三全册化学试题.docx
专题六化学能与电能的转化探考情悟真题【考情探究】考点考纲内容考试要求5年考情预测热度考题示例难度关联考点原电池原理及其应用(1)原电池的概念a☆☆☆☆☆(2)铜—锌原电池的原理及电极反应式b2015浙江10月选考,16,2分易氧化还原反应★☆☆☆☆(3)原电池的构成条件b☆☆☆☆☆(4)常见化学电源c2019浙江4月选考,12,2分易氧化还原反应★★☆☆☆(5)银锌电池、铅蓄电池、燃料电池的工作原理与应用价值b2017浙江4月选考,17,2分易氧化还原反应★★☆☆☆(6)原电池的构造与工作原理,盐桥的作用

高考化学一轮复习 专题六 化学能与电能的转化精练(含解析)-人教版高三全册化学试题.docx
专题六化学能与电能的转化【考情探究】课标解读内容原电池原理及其应用电解原理及其应用解读1.理解原电池的构成、工作原理及应用,能书写电极反应和总反应方程式2.了解金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施3.了解常见化学电源的种类及其工作原理理解电解池的构成、工作原理及应用,能书写电极反应和总反应方程式考情分析电化学是氧化还原反应知识的应用和延伸,是热点考查内容。通常会以新型二次电池为载体考查原电池原理与电解原理。试题难度中等,预计今后对本专题知识的考查会保持稳定备考策略本专题命题往往以
(浙江版)2021高考化学一轮复习 专题六 化学能与电能的转化精练(含解析).docx
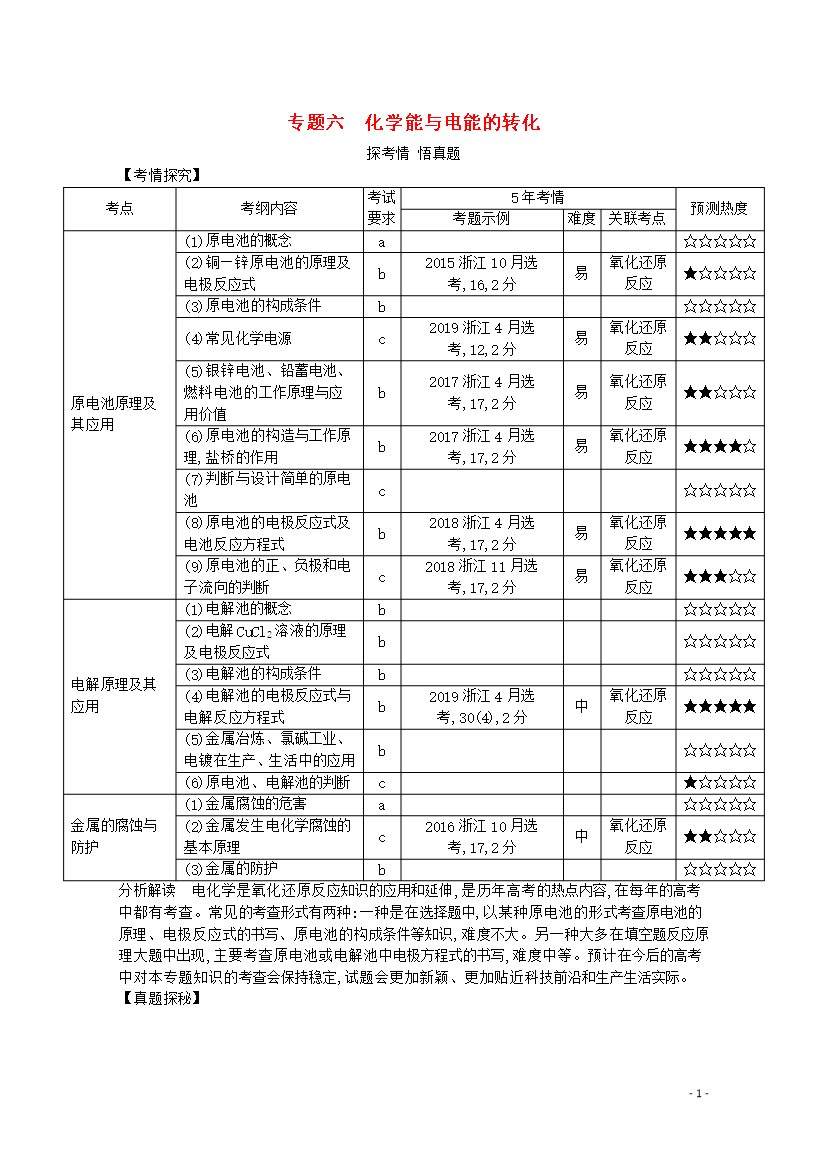
-25-专题六化学能与电能的转化探考情悟真题【考情探究】考点考纲内容考试要求5年考情预测热度考题示例难度关联考点原电池原理及其应用(1)原电池的概念a☆☆☆☆☆(2)铜—锌原电池的原理及电极反应式b2015浙江10月选考,16,2分易氧化还原反应★☆☆☆☆(3)原电池的构成条件b☆☆☆☆☆(4)常见化学电源c2019浙江4月选考,12,2分易氧化还原反应★★☆☆☆(5)银锌电池、铅蓄电池、燃料电池的工作原理与应用价值b2017浙江4月选考,17,2分易氧化还原反应★★☆☆☆(6)原电池的构造与工作原理,盐

(浙江版)2021高考化学一轮复习 专题六 化学能与电能的转化精练(含解析).docx
专题六化学能与电能的转化探考情悟真题【考情探究】考点考纲内容考试要求5年考情预测热度考题示例难度关联考点原电池原理及其应用(1)原电池的概念a☆☆☆☆☆(2)铜—锌原电池的原理及电极反应式b2015浙江10月选考,16,2分易氧化还原反应★☆☆☆☆(3)原电池的构成条件b☆☆☆☆☆(4)常见化学电源c2019浙江4月选考,12,2分易氧化还原反应★★☆☆☆(5)银锌电池、铅蓄电池、燃料电池的工作原理与应用价值b2017浙江4月选考,17,2分易氧化还原反应★★☆☆☆(6)原电池的构造与工作原理,盐桥的作用

(湖南版)高考化学一轮复习 专题7 化学能与电能的转化精练(含解析)-人教版高三全册化学试题.docx
专题7化学能与电能的转化【考情探究】课标解读考点原电池原理及其应用电解原理及其应用解读1.理解原电池的构成、工作原理及应用。能书写电极反应式和总反应方程式2.了解金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施3.认识化学能与电能相互转化的实际意义及其重要应用1.了解电解池的工作原理认识电解在实现物质转化和储存能量中的实际应用2.能书写电极反应式和总反应方程式考情分析电化学是氧化还原反应知识的应用和延伸是历年高考的热点。通常以新型二次电池为载体考查原电池原理与电解原理。试题难度中等预计在今
