
秋八年级科学上册 第1章 水和水的溶液 专题训练(三)溶液课件 (新版)浙教版-(新版)浙教版初中八年级上册自然科学课件.ppt

小宏****aa








亲,该文档总共25页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

秋八年级科学上册 第1章 水和水的溶液 专题训练(三)溶液课件 (新版)浙教版-(新版)浙教版初中八年级上册自然科学课件.ppt
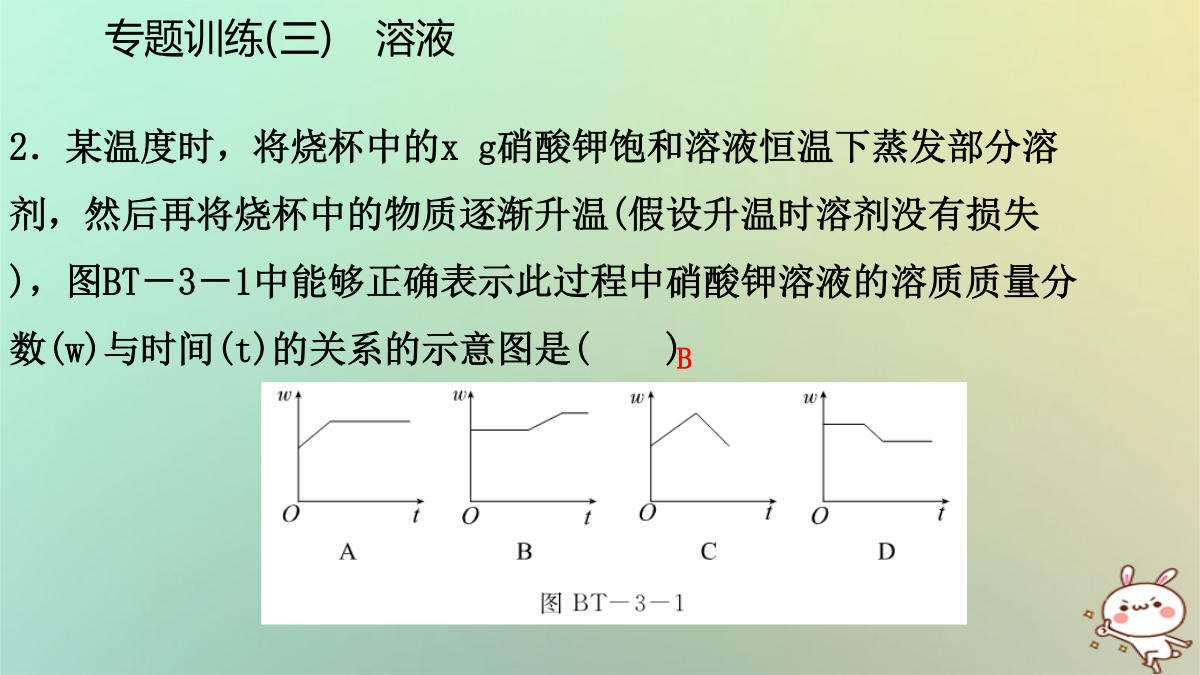
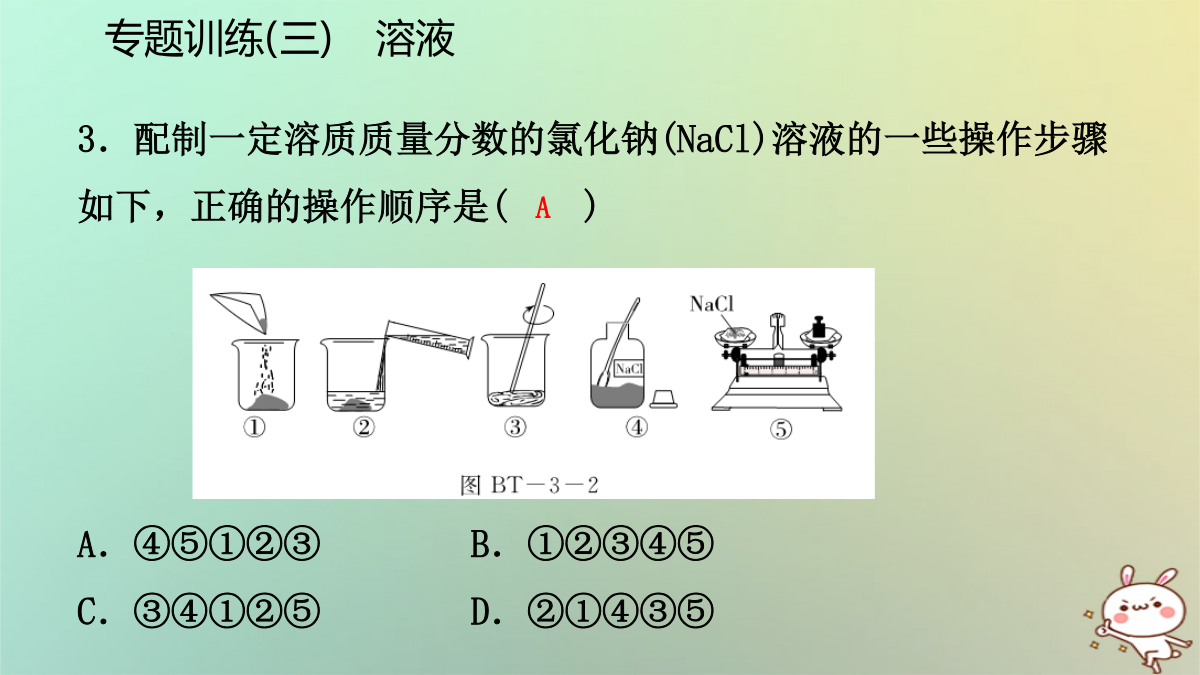
专题训练(三)溶液一、选择题1.[2017·聊城]下列关于溶液说法正确的是()A.将氯化钠和植物油放入水中,充分搅拌后都能形成溶液B.把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10%C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解D.配制50g16%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤专题训练(三)溶液专题训练(三)溶液4.台州是个海滨城市,有充足的海水资源。人们常把海水引入盐田,经过风吹日晒使海水中的水分蒸发获得粗盐,在这个过程中()A.水的质量不变B.氯化钠的

2018年秋八年级科学上册 第1章 水和水的溶液 专题训练(三)溶液课件 (新版)浙教版.ppt
专题训练(三)溶液一、选择题1.[2017·聊城]下列关于溶液说法正确的是()A.将氯化钠和植物油放入水中,充分搅拌后都能形成溶液B.把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10%C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解D.配制50g16%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤专题训练(三)溶液专题训练(三)溶液4.台州是个海滨城市,有充足的海水资源。人们常把海水引入盐田,经过风吹日晒使海水中的水分蒸发获得粗盐,在这个过程中()A.水的质量不变B.氯化钠的

秋八年级科学上册 第1章 水和水的溶液 专题训练(二)浮力的综合计算课件 (新版)浙教版-(新版)浙教版初中八年级上册自然科学课件.ppt
专题训练(二)浮力的综合计算一、选择题1.[2017·成都]将一小石块浸没在水中,放手后小石块沉入水底,在小石块下沉过程中,下列分析正确的是()A.浮力变大B.浮力变小C.浮力大于重力D.浮力小于重力专题训练(二)浮力的综合计算专题训练(二)浮力的综合计算4.如图BT-2-2所示,密度均匀的木块漂浮在水面上,现沿虚线将下部分截去,则剩下的部分将()A.上浮一些B.静止不动C.下沉一些D.无法确定5.[2017·广东]将体积相同材料不同的甲、乙、丙三个实心小球,分别轻轻放入三个装满水的相同烧杯中,甲球下沉至

八年级科学上册 第1章 水和水的溶液 第3节 水的浮力教学课件 (新版)浙教版-(新版)浙教版初中八年级上册自然科学课件.pptx
教学课件第1章水和水的溶液第3节水的浮力浮力方向:二、浮力的概念把空矿泉水瓶用手逐渐按入水中,感受浮力。浮力的大小探究浮力与哪些因素有关浮力知识复习三、阿基米德原理:阿基米德

八年级科学上册 第1章 水和水的溶液 第2节《水的组成》课件1 (新版)浙教版-(新版)浙教版初中八年级上册自然科学课件.ppt
1.2水的组成复习提问练习:物理变化和化学变化的判断1.下列现象中,属于化学变化的是()A.玻璃破裂B.车胎漏气C.煤气燃烧D.空气液化2.下列过程属于物理变化的是()A.煤的燃烧B.冰的融化成水C.蜡烛燃烧D.食物变质3.物质发生化学变化时一定有()A.颜色变化B.气体、沉淀或水生成C.放热、发光D.新物质生成在水循环的过程中,水发生了____(填“物理”或“化学)变化,因为水在该过程中____(填“有”或“没有”)变成其他物质,只是发生了状态(形态)变化。新设想电解水实验:水的电解我们可以自制水电解装
