
电化学与金属腐蚀.pptx

快乐****蜜蜂









亲,该文档总共179页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

电化学与金属腐蚀.pptx
会计学定温定压下,非自发(zìfā)反应(ΔG>0)需加入电功W,电解才能进行。电化学及其应用电解冶金:Fe,Cu,Na,Al等的冶炼、精炼电电化学(电能化工产品:NaOH,H2O2,Cl2已二酸的化学能)生产,发展迅速工艺学电镀,电抛光,电解磨削各种蓄电池、干电池化化学电源高能电池:Li、Zn-空气、Na-S(化学能燃料电池电能)金属腐蚀与防护——腐蚀原电池学分析化学:氧化还原平衡、电导、电势滴定,极谱科研分析生物电化学:血液凝固、神经系统(shénjīngxìtǒng)的传输固体电解质和半导体,低

电化学与金属腐蚀PPT课件.ppt
第四章电化学与金属腐蚀4.1原电池负极(cathode):电子流出,氧化反应电极:组成原电池的导体金属导体如Cu、Zn(参与电极反应)惰性导体如Pt、石墨棒(不参与电极反应)电极类型(Thevarioustypesofelectrodes)●金属-金属难溶盐电极纯液体、固体和气体写在惰性电极一边用“,”分开例:将下列反应设计成原电池并以原电池符号表示例:将下列反应设计成原电池并以原电池符号表示4.1.2原电池的热力学ΔrGm=w'max=-QE=-nFE4.2.1电极电势(ElectrodePotenti

参考课件电化学金属腐蚀.ppt
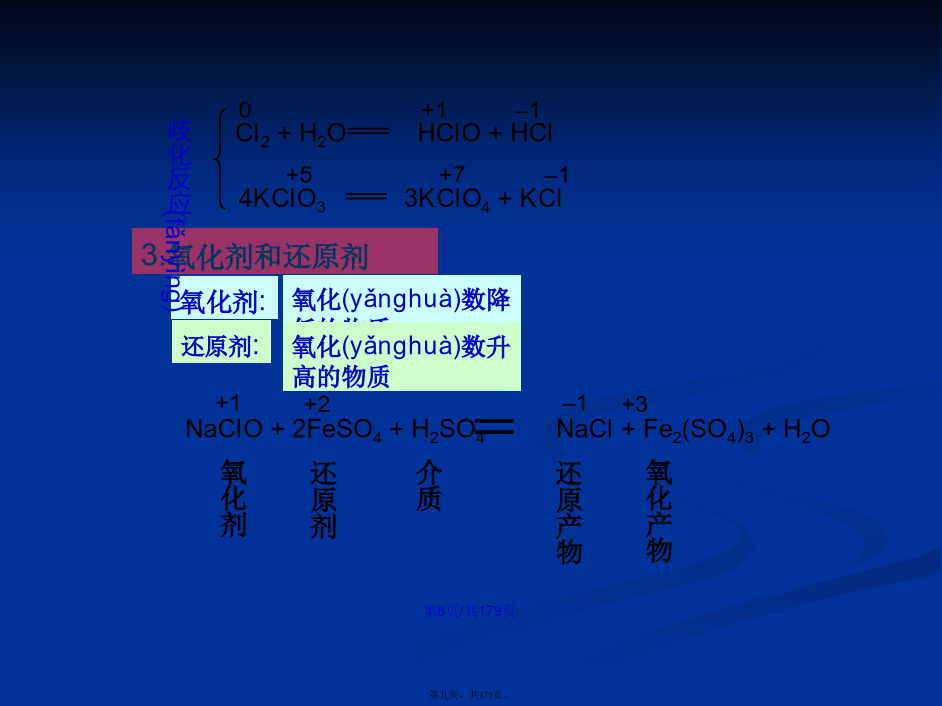
第四章电化学金属腐蚀基本要求氧-还反应的实质**补充无机化学反应可分为两大类:一类是非氧化还原反应如复分解反应、中和反应、盐类水解和某些配合反应等这些反应的特点是反应物中原子或离子没有氧化数的变化;另一类是氧化还原反应所有氧-还反应的共同特点是反应物中某些元素的氧化数发生了变化。一、氧化数的规定单质中元素的氧化数为零H2Cl2Fe正常氧化物中O的氧化数为-2过氧化物(H2O2、Na2O2)中O的氧化数为-1KO2中O的氧化数为-0.5KO3中O的氧化数为-1/3OF2中O的氧化数

【精选】电化学基础与金属腐蚀.ppt
第六章电化学基础与金属腐蚀6.1氧化还原反应与氧化还原平衡oxidation:物质失去电子的作用。reduction:物质获得电子的作用。H2:失去电子被氧化是还原剂。Cl2:得到电子被还原是氧化剂。3.电化学氧化还原反应c.电化学氧化还原反应的特点4.一些基本概念正极:电势高的电极。电流从正极流向负极。原电池中正极-阴极;电解池中正极-阳极。负极:电势低的电极。电子从负极流向正极。原电池中负极-阳极;电解池中负极-阴极。氧化数(oxidationnumber):某元

防止金属腐蚀的电化学方法.pdf
防止金属腐蚀的电化学方法-概述说明以及解释1.引言1.1概述金属腐蚀是指金属在与外界环境接触时,由于化学反应导致金属表面的物质损失的现象。腐蚀不仅会造成金属的损坏和破坏,还会对各行业的生产设备、建筑物和基础设施等产生巨大的经济损失。因此,探索有效的防腐蚀方法对于保护金属材料的使用寿命和安全性具有重要意义。电化学防腐蚀是一种常用的防腐蚀方法,它利用电化学原理干预金属与环境之间的电化学反应,从而减缓或阻止金属腐蚀的过程。其基本思想是在金属表面形成一层保护膜,阻隔金属与外界环境的直接接触。电化学防腐蚀方法可以通
