
诊疗一体化纳米药物的制备及其在三阴性乳腺癌治疗中的应用的任务书.docx

骑着****猪猪



在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

诊疗一体化纳米药物的制备及其在三阴性乳腺癌治疗中的应用的任务书.docx
诊疗一体化纳米药物的制备及其在三阴性乳腺癌治疗中的应用的任务书任务书一、任务背景乳腺癌是女性常见的恶性肿瘤之一,其中三阴性乳腺癌占所有乳腺癌病例的15-20%。三阴性乳腺癌不表达雌激素受体、孕激素受体和HER2蛋白,因此无法通过靶向这些受体来治疗。在化疗方面,三阴性乳腺癌的药物耐药性较高,常规化疗的疗效有限。因此,开发新的治疗手段对于三阴性乳腺癌的治疗至关重要。纳米药物是一种较新的治疗手段,具有高载药量、靶向性强、药效稳定等优点,被广泛应用于肿瘤治疗中。目前,针对三阴性乳腺癌的纳米药物研究仍处于初期阶段,
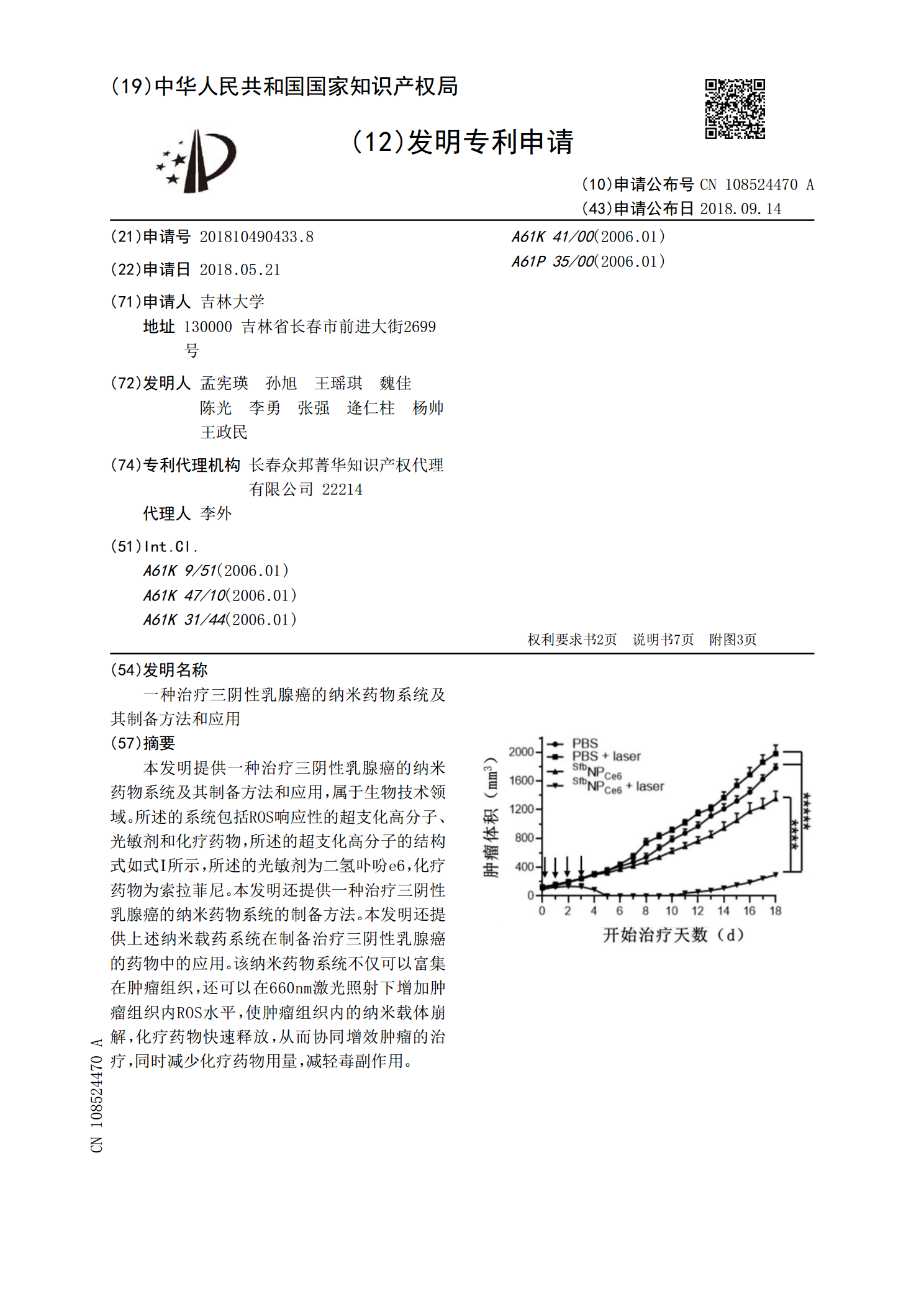
一种治疗三阴性乳腺癌的纳米药物系统及其制备方法和应用.pdf
本发明提供一种治疗三阴性乳腺癌的纳米药物系统及其制备方法和应用,属于生物技术领域。所述的系统包括ROS响应性的超支化高分子、光敏剂和化疗药物,所述的超支化高分子的结构式如式Ⅰ所示,所述的光敏剂为二氢卟吩e6,化疗药物为索拉菲尼。本发明还提供一种治疗三阴性乳腺癌的纳米药物系统的制备方法。本发明还提供上述纳米载药系统在制备治疗三阴性乳腺癌的药物中的应用。该纳米药物系统不仅可以富集在肿瘤组织,还可以在660nm激光照射下增加肿瘤组织内ROS水平,使肿瘤组织内的纳米载体崩解,化疗药物快速释放,从而协同增效肿瘤的治

用于靶向抑制三阴性乳腺癌siRNA联合药物的纳米递送系统及其制备方法和应用.pdf
本发明公开了用于靶向抑制三阴性乳腺癌siRNA联合药物的纳米递送系统及其制备方法和应用,属于医学技术领域。所述纳米递送系统的制备方法包括:(1)4条DNA单链以相同浓度混合在TM缓冲液中,加热至95℃保持10min,冷却,形成四面体结构TND;(2)将OTUD6BsiRNA与所述TND于37℃混合孵育,冷却,得到Td?siRNA纳米粒;(3)将所述Td?siRNA与抑制三阴性乳腺癌的药物混合孵育,即得终产物。通过实验验证,该纳米递送系统能够显著的提高抑制三阴性乳腺癌药物DOX或PTX的治疗效果。

用于靶向抑制三阴性乳腺癌siRNA联合药物的纳米递送系统及其制备方法和应用.pdf
本发明公开了用于靶向抑制三阴性乳腺癌siRNA联合药物的纳米递送系统及其制备方法和应用,属于医学技术领域。所述纳米递送系统的制备方法包括:(1)4条DNA单链以相同浓度混合在TM缓冲液中,加热至95℃保持10min,冷却,形成四面体结构TND;(2)将OTUD6BsiRNA与所述TND于37℃混合孵育,冷却,得到Td?siRNA纳米粒;(3)将所述Td?siRNA与抑制三阴性乳腺癌的药物混合孵育,即得终产物。通过实验验证,该纳米递送系统能够显著的提高抑制三阴性乳腺癌药物DOX或PTX的治疗效果。

靶向ASBEL的反义核苷酸在三阴性乳腺癌联合治疗中的应用的任务书.docx
靶向ASBEL的反义核苷酸在三阴性乳腺癌联合治疗中的应用的任务书任务书一、研究背景三阴性乳腺癌是一种恶性肿瘤,其特点是不表达雌、孕激素受体和HER2受体,因此不能应用内分泌治疗和靶向HER2治疗。在临床治疗中,三阴性乳腺癌通常采用化疗、放疗和手术等综合治疗,但疗效有限且容易产生耐药性。因此,研究新的治疗方法具有极其重要的临床意义。ASBEL是PAX9家族的一员,与细胞增殖、转移及侵袭等多个生物学过程密切相关。ASBEL高表达与三阴性乳腺癌的预后不良和化疗耐药性明显相关。近年来,研究者通过构建ASBEL靶向
