
高考化学复习专题 物质的组成、性质和分类 (7)课件.ppt

天马****23









亲,该文档总共79页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

高考化学复习专题 物质的组成、性质和分类 (7)课件.ppt
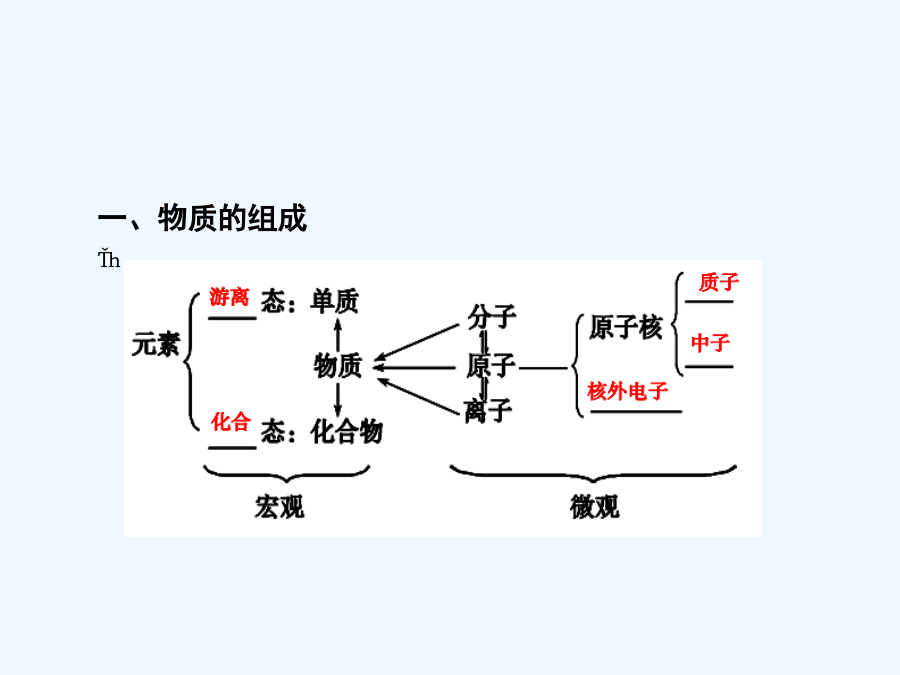
专题十一物质的组成、性质和分类(7)一、物质的组成二、物质的分类1.基本类型(1);(2);(3);(4)。2.根据是否有电子转移(1);(2)。3.根据反应热效应(1);(2)。4.根据是否有离子参与(1);(2)。四、胶体(4)用水解法制备的Fe(OH)3胶体中含有Fe3+、Cl-,可用进行提纯。辨析1:物理变化和化学变化的判断物质变化中的“三色”、“五解”、“十八化”注意①化学变化中常伴有发光、放热现象,但有发光、放热现象的变化不一定属于化学变化,如金属受热发光。②化学变化中一

高考化学复习专题 物质的组成、性质和分类 (1)课件.ppt
专题十一物质的组成、性质和分类(1)答案CCDBACEFBABDAA返回
高考化学复习专题 物质的组成、性质和分类 (4)课件.ppt

高考化学复习专题一 物质的组成、性质和分类.pdf
专题一物质的组成、性质和分类【命题趋势探秘】考查内容物质的组成物质的分类物质的性质与变化命题考查热度规律考查题型所占分值对于胶体知识,应重点理解胶体的特征和丁达尔现象,要注意渗析和丁达尔现象都是物理变化。从命题的趋势看,有关胶体的试题有向着考查胶体性质及基本知识与科技生活、生产相结合命题的问题靠近的趋势,试题的形式为选择题的可能性比较大。趋势从历年高考试题来看,其考查方式灵活多样,可以独立命题考查,也可以贯穿于填空、推断、实验、计算等各类试题之中。氧化性、还原性的强弱比较,中电子转移的方向和数目的表示,以

高考化学(广东专用)专题复习篇课件 物质的组成、性质和分类.ppt
专题一化学基本概念本学案栏目开关①③④⑥⑦⑨×①②③④⑦⑧⑩√③本学案栏目开关本学案栏目开关D本学案栏目开关本学案栏目开关本学案栏目开关本学案栏目开关本学案栏目开关本学案栏目开关本学案栏目开关本学案栏目开关DA本学案栏目开关本学案栏目开关金属本学案栏目开关BB本学案栏目开关本学案栏目开关本学案栏目开关本学案栏目开关本学案栏目开关本学案栏目开关本学案栏目开关B
