 预览加载中,请您耐心等待几秒...
预览加载中,请您耐心等待几秒...

1/10

2/10

3/10
4/10

5/10

6/10

7/10

8/10

9/10

10/10
亲,该文档总共17页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
中药研发基础知识中药新药分类:
1、未在国内外上市销售的药品.
2、改变给药途径且尚未在国内外上市销售的制剂
3、已在国外上市销售但尚未在国内上市销售的药品
4、改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂
5、改变国内已上市销售药品的剂型,但不改变给药途径的制剂
6、已有国家药品标准的原料药或者制剂
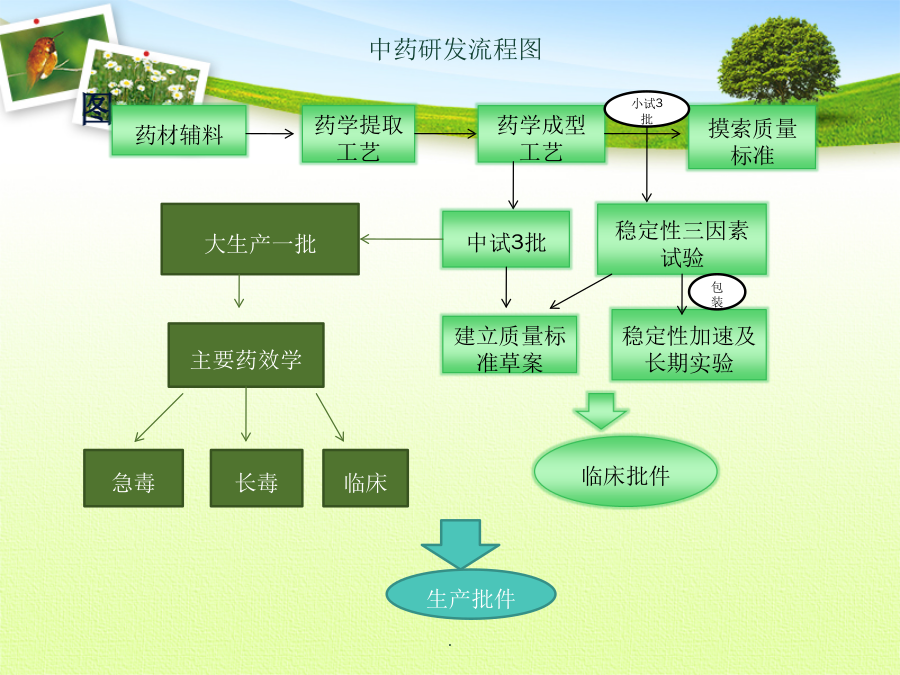
1、调研2、立项:确定配方、剂型3、实验室研究:进行制备工艺、质量标准等药学工作4、药理、毒理学研究5、临床前研究资料准备6、完成Ⅰ、Ⅱ、Ⅲ期临床研究7、申请新药证书及生产批文图对于现代药业而言,新产品开发立项之前,必须对市场做全盘的了解,使预期生产与预期销售能密切配合。市场是现代企业经营管理中最重要的一环,也是一项必须实施的要务。成功的企业,都很重视开发新产品前期的市场调研,单凭个人灵感或主观直觉开发的新产品根本无法幸存于现今竞争激烈的市场。市场调研直接对新药立项起指导作用,它可以帮助中药企业得到更加全面、准确的调研数据,使中药企业系统的、客观的收集、分析和评价中药新药开发立项前期的各个方面的信息,从而帮助中药企业做出有利于新药开发的决策,尽可能为中药企业研制开发中药新药降低风险。2.1、处方确定:根据市场调研数据统计,确定研发新品处方及剂型。2.2、运用中医理论、临床经验和现代科学技术进行中药新药发现,通过经方、验方、祖传秘方等临床有效处方,科研方和天然药物的挖掘整理,科学分析,为创新药物发现提供处方来源。2.3、以处方中药材的性质及服用量来确定剂型。3、实验室研究4、药理、毒理学研究综述资料:1.药品名称。2.证明性文件。3.立题目的与依据。4.对主要研究结果的总结及评价。5.药品说明书样稿、起草说明及最新参考文献。6.包装、标签设计样稿。药学研究资料:7.药学研究资料综述。8.药材来源及鉴定依据。10.药材标准草案及起草说明,并提供药品标准物质及有关资料。12.生产工艺的研究资料、工艺验证资料及文献资料,辅料来源及质量标准。13.化学成份研究的试验资料及文献资料。14.质量研究工作的试验资料及文献资料。15.药品标准草案及起草说明,并提供药品标准物质及有关资料。16.样品检验报告书。17.药物稳定性研究的试验资料及文献资料。18.直接接触药品的包装材料和容器的选择依据及质量标准。药理毒理研究资料:19.药理毒理研究资料综述。20.主要药效学试验资料及文献资料。21.一般药理研究的试验资料及文献资料。22.急性毒性试验资料及文献资料。23.长期毒性试验资料及文献资料。24.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性、依赖性等主要与局部、全身给药相关的特殊安全性试验资料和文献资料。25.遗传毒性试验资料及文献资料。26.生殖毒性试验资料及文献资料。27.致癌试验资料及文献资料。28.动物药代动力学试验资料及文献资料。每一种候选药物或疫苗在获得使用批准之前,必须在志愿者中间进行严格的系统性测试以对新产品是否可以应用于更广泛的人群进行评估6、临床研究6、临床研究《药品注册批件》是国家食品药品监督管理局批准某药品生产企业生产该品种,发给“批准文号”的法定文件,通俗点说,就是这个药品的“出生证”,也就是通常说的“生产批件”。同一种药品,如果政策许可,可能会有多家药厂申请注册,经国家审查合格后,会批准给多家药厂生产,因此各药厂都会有该药品的《药品注册批件》只是“批准文号”不一样。《新药证书》是国家药监局通过对新药注册申报资料全面审查,符合规定的发给新药申请人(指提出药品注册申请,承担相应法律责任,并在该申请获得批准后持有药品批准证明文件的机构。)的法定权属文件,同时还发给该新药的《药品注册批件》。持有《新药证书》并能生产该药品的企业,在《药品注册管理办法》规定的时间内,国内只此一家。《新药证书和生产批件》这样的批准文件的形式还没有见过。按规定,《新药证书》是可以转让的,而“生产批件”是不能转的。谢谢此课件下载可自行编辑修改,供参考!
感谢您的支持,我们努力做得更好!
















