
新药研发概论.ppt

17****92





亲,该文档总共58页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

新药研发概论.ppt
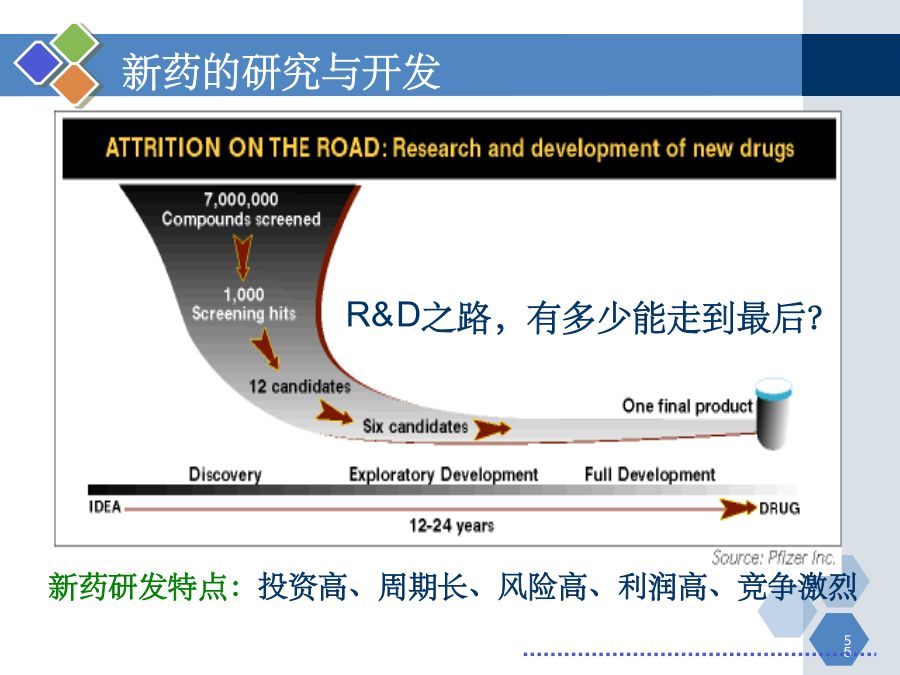
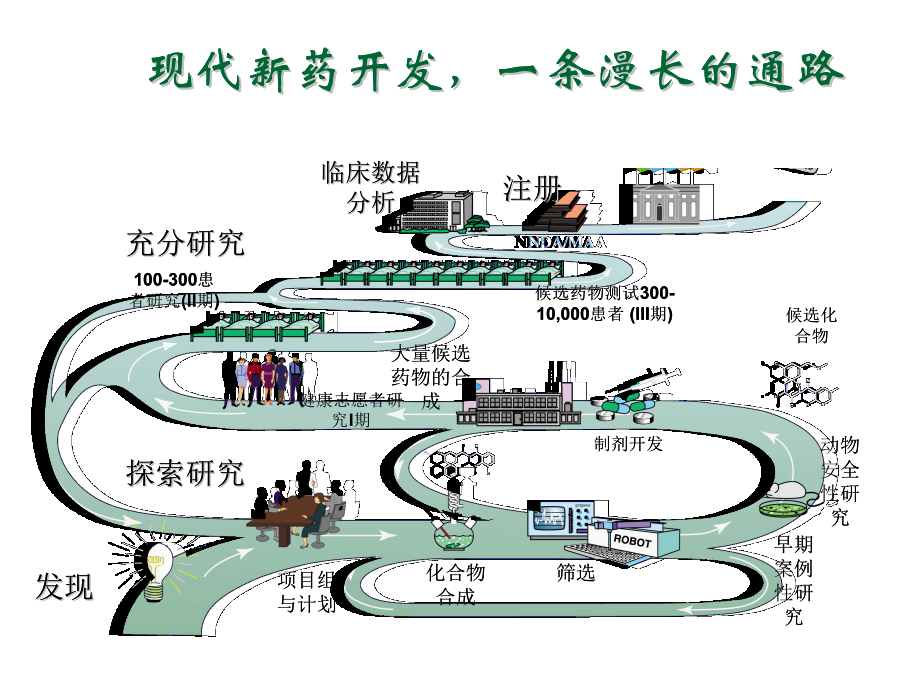
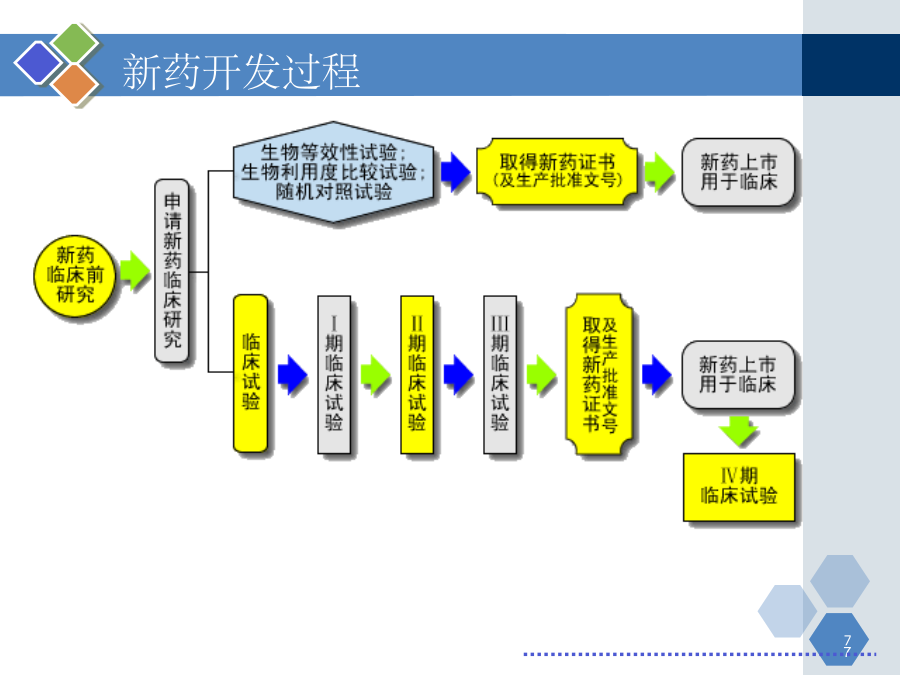
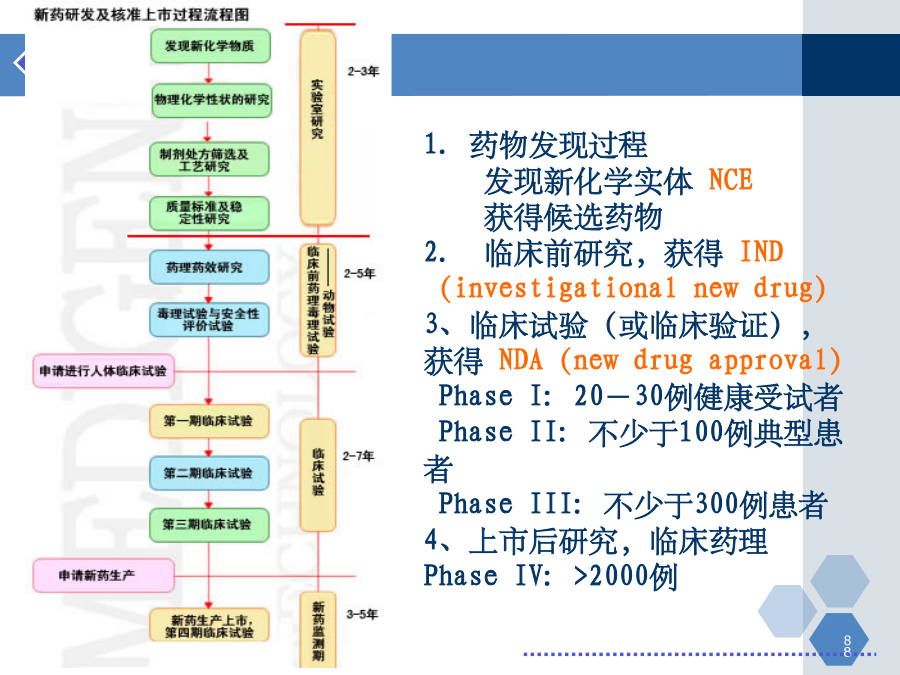
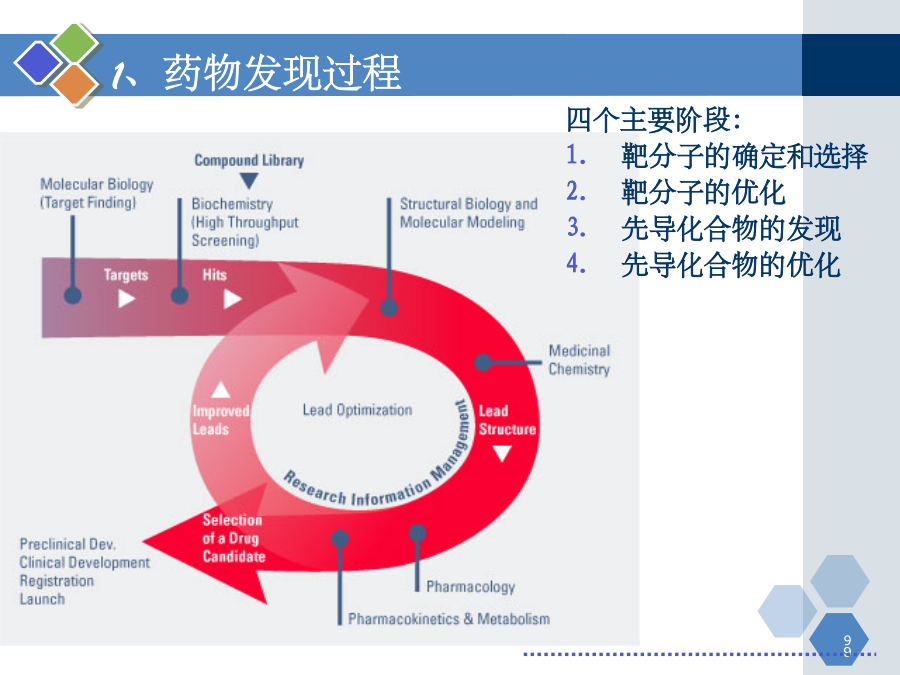
第一章新药研发概论主要内容第一节新药研究与开发的过程和方法新药的研究与开发新药研发特点:投资高、周期长、风险高、利润高、竞争激烈新药开发过程1.药物发现过程发现新化学实体NCE获得候选药物2.临床前研究获得IND(investigationalnewdrug)3、临床试验(或临床验证)获得NDA(newdrugapproval)PhaseI:20-30例健康受试者PhaseII:不少于100例典型患者PhaseIII:不少于30

新药研发概论.ppt
第一章新药研发概论主要内容第一节新药研究与开发的过程和方法新药的研究与开发新药研发特点:投资高、周期长、风险高、利润高、竞争激烈新药开发过程1.药物发现过程发现新化学实体NCE获得候选药物2.临床前研究,获得IND(investigationalnewdrug)3、临床试验(或临床验证),获得NDA(newdrugapproval)PhaseI:20-30例健康受试者PhaseII:不少于100例典型患者PhaseIII:不少于300例患者4、上市后研究,临床药理PhaseIV:>2000例1、药物发现过

新药研发概论.ppt
第一章新药研发概论主要内容第一节新药研究与开发的过程和方法新药的研究与开发新药研发特点:投资高、周期长、风险高、利润高、竞争激烈新药开发过程1.药物发现过程发现新化学实体NCE获得候选药物2.临床前研究,获得IND(investigationalnewdrug)3、临床试验(或临床验证),获得NDA(newdrugapproval)PhaseI:20-30例健康受试者PhaseII:不少于100例典型患者PhaseIII:不少于300例患者4、上市后研究,临床药理PhaseIV:>2000例1、药物发现过

新药研发概论.ppt
第一章新药研发概论主要内容第一节新药研究与开发的过程和方法新药的研究与开发新药研发特点:投资高、周期长、风险高、利润高、竞争激烈新药开发过程1.药物发现过程发现新化学实体NCE获得候选药物2.临床前研究获得IND(investigationalnewdrug)3、临床试验(或临床验证)获得NDA(newdrugapproval)PhaseI:20-30例健康受试者PhaseII:不少于100例典型患者PhaseIII:不少于30

新药研发中专利信息的检索概论.ppt
新药研发中的专利信息的检索中小企业与知识产权研讨会从狭义上是指专利说明书、权利要求书、说明书附图、说明书摘要等文献中所承载的信息;广义上是指各种专利申请文件、专利公报、专利分类表、专利索引、专利题录、专利文摘、专利证书等文献中所承载的以及专利活动中所产生的信息。表示技术信息的内容:发明创造名称、摘要、专利分类号、说明书等。表示法律信息的内容有:权利要求书、申请人、发明人、专利权人、专利申请号、申请日期、优先申请号、优先申请日期、优先申请国家、文献号、专利或专利申请的公布日期、国内相关申请数据等。表示经济信
