
醛酮醌.ppt

lj****88




亲,该文档总共69页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料
醛酮醌.ppt
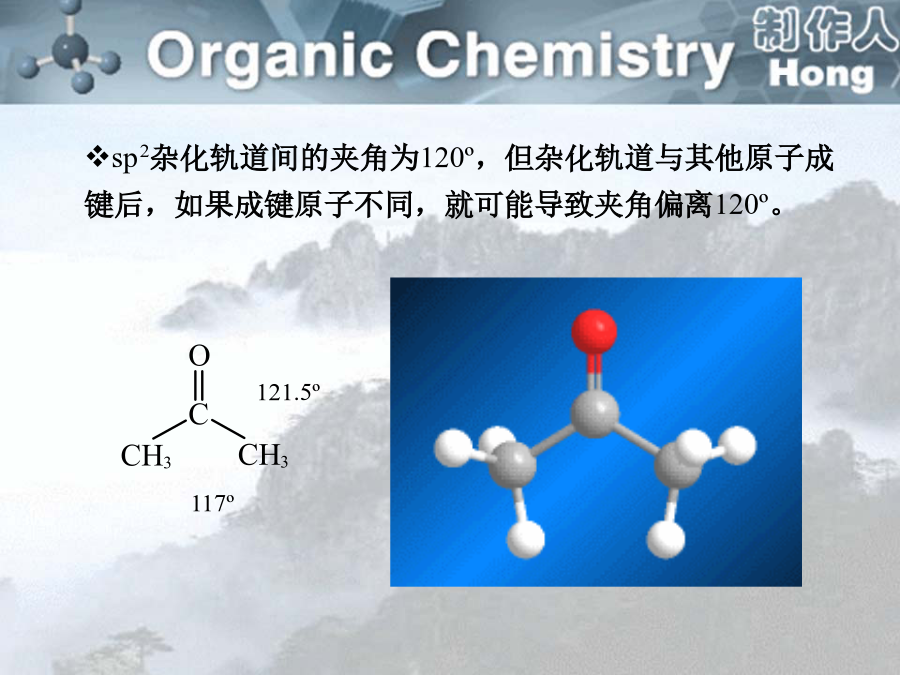
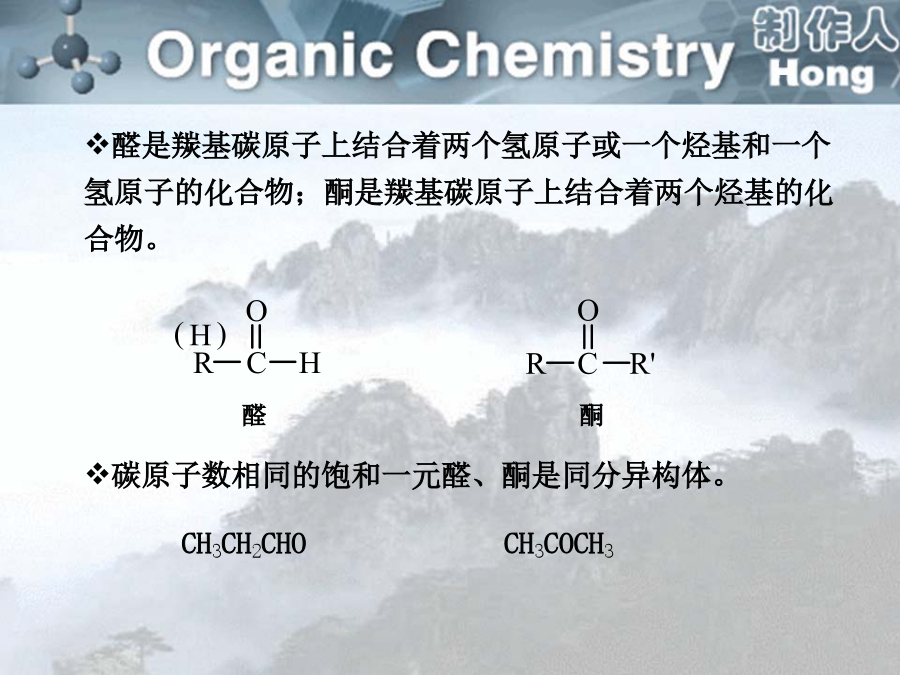
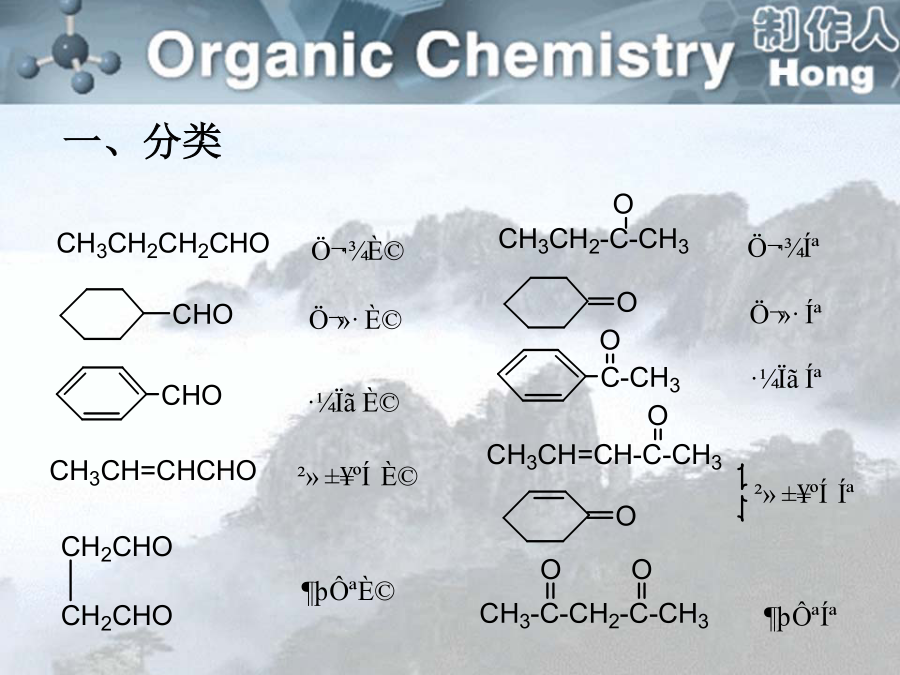
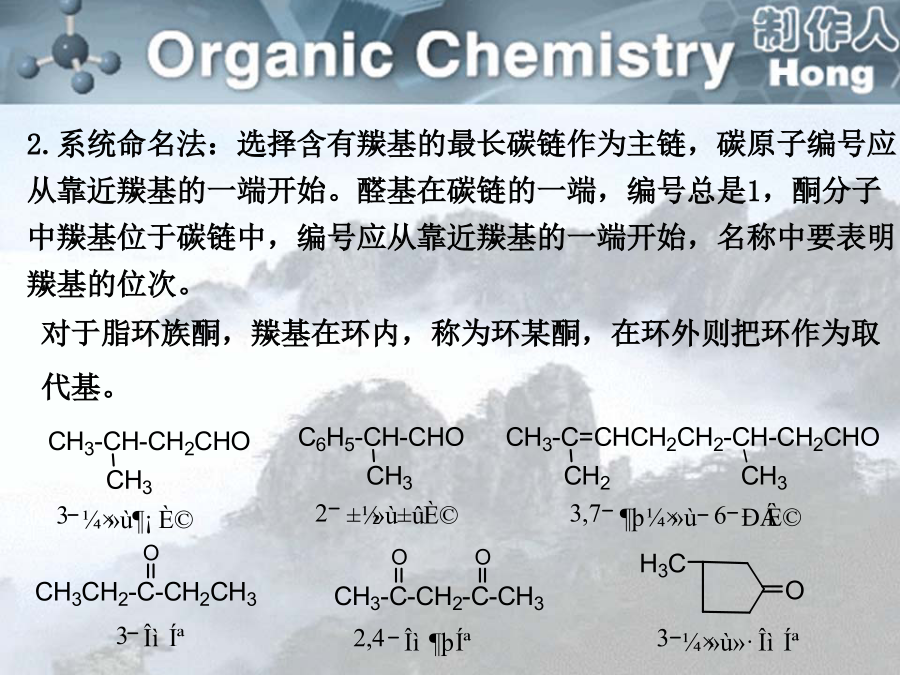
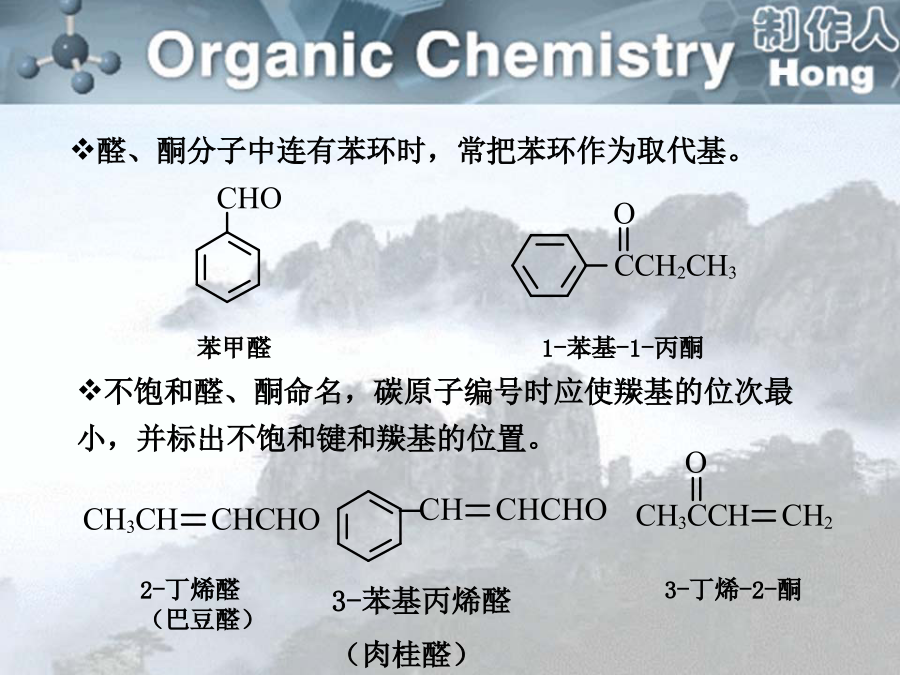
sp2杂化轨道间的夹角为120º,但杂化轨道与其他原子成键后,如果成键原子不同,就可能导致夹角偏离120º。醛是羰基碳原子上结合着两个氢原子或一个烃基和一个氢原子的化合物;酮是羰基碳原子上结合着两个烃基的化合物。一、分类醛:取代基+某醛:从醛基相邻的碳开始称αβγδ…2.系统命名法:选择含有羰基的最长碳链作为主链,碳原子编号应从靠近羰基的一端开始。醛基在碳链的一端,编号总是1,酮分子中羰基位于碳链中,编号应从靠近羰基的一端开始,名称中要表明羰基的位次。醛、酮分子中连有苯环时,常把苯环作为取代基。碳原子的编

醛酮醌习题.docx
本章节主要内容:一、醛酮的命名二、醛、酮的化学性质(一)亲核加成1、*理解机理,能判断不同结构的醛酮加成活性2、*与氢氰酸加成的范围及在合成上的应用;*与饱和亚硫酸氢钠反应的范围及鉴别上的应用;**与醇加成,能够完成方程式,特别是自身带有羟基的醛,并能够写出缩醛水解后的产物,注意在合成上用于保护羟基;与氨衍生物加成的方程式和在鉴别上的应用;***与格氏试剂的加成及其在合成上的应用。(二)氢的反应、*烯醇式与酮式互变异构:理解并能判断哪些烯醇式比稳定。、***羟醛缩合,能完成方程式,掌握在合成上的应

醛、酮和醌0.ppt
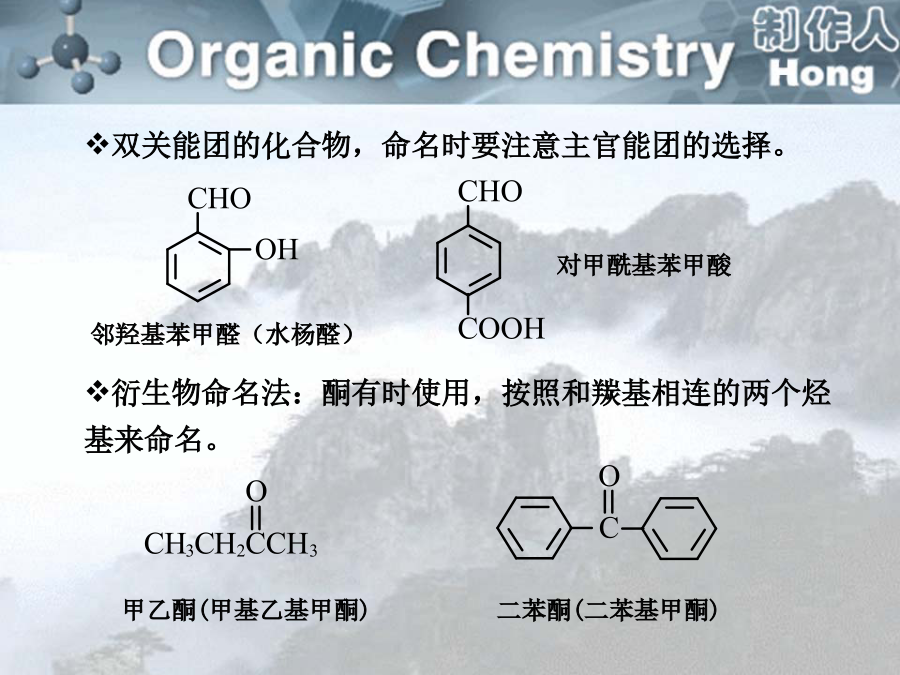
第十一章按含羰基数目分第十一章一、醛酮的命名2.系统命名法邻羟基苯甲醛(水杨醛)命名醛酮化合物时,以醛为母体,将酮的羰基氧原子作为取代基,用“氧代”二字表示。也可以酮醛为母体,但需注明酮的羰基碳原子位次。一、醛酮的命名第十一章1.醛和酮的工业合成(3)烷基苯的选择氧化2.醛和酮的实验室合成二、醛酮的制法(4)醇的氧化氧化不饱和醇生成相应的醛酮二、醛酮的制法二、醛酮的制法二、醛酮的制法第十一章溶解性:1)低级醛酮可溶于水。因为醛、酮的极性强,且与水分子之间能形成氢键。2)随着分子中烃基部分增大,在水中溶解度

醛酮醌青岛大学.ppt
第三节醛、酮和醌(H)R—C—H3.1醛、酮3.1.2醛、酮的结构3.1.3醛和酮的物理性质3.1.4醛和酮的化学性质1、羰基的亲核加成反应CH3(2)加亚硫酸氢钠(3)与醇加成应用2)缩酮的生成(4)与格氏试剂加成CH3CHCH2CHOCH3H+加成-消除产物的结构及名称:加成反应的活性与试剂亲核性强弱、羰基碳原子亲电性强弱、羰基所连R基大小,即电子效应、立体效应等因素有关。3.1.4醛和酮的化学性质用碱催化时,卤代速度比酸催化快得多(2)羟醛缩合反应——(增长碳链的反应)机理交叉羟醛缩合3.1.4醛和

有机醛酮醌学习教案.pptx
会计学2024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/292024/10/2920
