
例析反应热的三种计算方法 学法指导 不分版本.doc

努力****妙风

在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

秦汉时期易错题例析 学法指导(不分版本).rar
用心爱心专心119号编辑2秦汉时期易错题例析学法指导(不分版本)http://www.DearEDU.com河南/刘森例1:秦始皇“焚书坑儒”的主要目的是A.禁止儒学传播B.钳制思想C.加强专制统治D.摧残文化[解析]本题从因果关系的角度考查学生的分析能力。解答的关键是要正确理解题干的中心词“主要”和“目的”两个层次。钳制思想和摧残文化属于“焚书坑儒”的影响。而禁止儒学传播只是一种表象,目的是为其专制服务的。大家容易混淆“目的”和“影响”两个概念,同时有可能忽视“主要”二字,直观地认为“焚书坑儒”就是要“

例析光现象中的思维方法 学法指导 不分版本 试题.doc
例析光现象中的思维方法郑永常1.模型法所谓“模型法”是指通过建立物理模型来研究学习、分析处理和解决物理问题的一种思维方法。很多实际问题是复杂的较难研究的而将其转化成物理模型会使问题直观、形象、简单化。在研究光现象时把光源看作一个发光点不考虑它的形状、大小及亮度;用光线来形象地表示光都是为了便于研究和作图。2.等效替代法“等效替代法”是指在效果等同的前提下把抽象、复杂的物理过程或现象变换成理想、简单的过程或现象来研究处理的方法。在“研究平面镜成像特点”的实验中如图1所示就利用了等

历史易错选择题分类例析 学法指导 不分版本.rar
用心爱心专心119号编辑2历史易错选择题分类例析http://www.DearEDU.com湖南曹中原学生在解题过程中难免会出现判断失误的情况,而导致失误的原因往往就是学生对知识理解不透或能力有所欠缺,因此及时纠错,建立“错题档案”,找出归因性根源,是巩固知识、提高能力的好办法。一.历史本质类例1.二战后东西方长达近半个世纪对峙的实质是()A.两种文化传统的竞争B.两种政治势力的争夺C.两种军事力量的较量D.两种意识形态的对立解析:本题易错选A、C、D三项。二战后东西方对峙的实质是两极格局,而两极格局的实
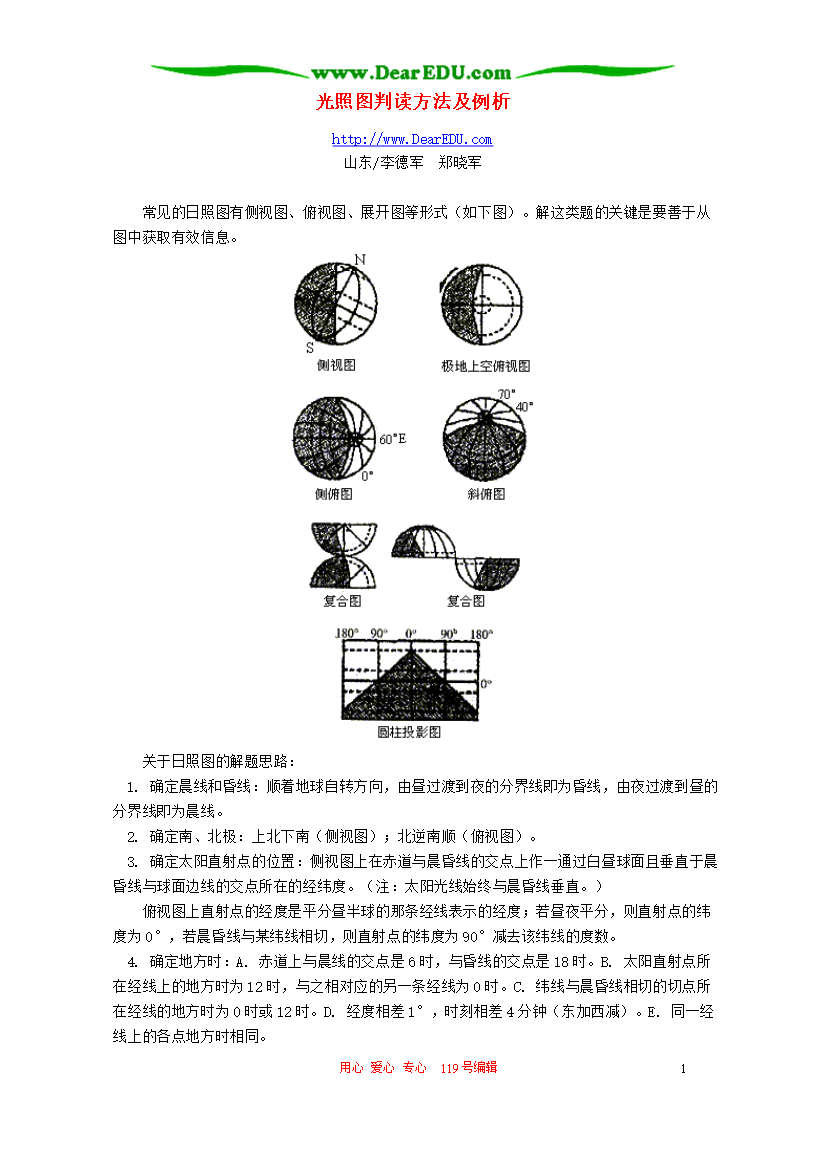
试题-全国-2006_光照图判读方法及例析 学法指导 不分版本.rar
用心爱心专心119号编辑3光照图判读方法及例析http://www.DearEDU.com山东/李德军郑晓军常见的日照图有侧视图、俯视图、展开图等形式(如下图)。解这类题的关键是要善于从图中获取有效信息。关于日照图的解题思路:1.确定晨线和昏线:顺着地球自转方向,由昼过渡到夜的分界线即为昏线,由夜过渡到昼的分界线即为晨线。2.确定南、北极:上北下南(侧视图);北逆南顺(俯视图)。3.确定太阳直射点的位置:侧视图上在赤道与晨昏线的交点上作一通过白昼球面且垂直于晨昏线与球面边线的交点所在的经纬度。(注:太阳光

试题-全国-2006_例析海水盐度的影响因素 学法指导 不分版本.rar
用心爱心专心119号编辑2例析海水盐度的影响因素http://www.DearEDU.com湖北/卢查元海水盐度的一般分布规律是:由南北半球副热带海区分别向两侧的高纬度和低纬度递减。从这一规律可以看出,海水盐度大小并非从赤道向两极递减,即海水的盐度分布规律并不是与海水温度的纬度分布规律相吻合,因为影响海水盐度的因素除气候因素外,还受洋流、陆地径流、结冰与融冰、海域的封闭与否等因素影响。一.气候因素影响海水的气候因素主要考虑“降水量与蒸发量的对比关系”。因为降水使海水稀释,而蒸发使海水浓缩,因此在外海和大洋
