
化学竞赛无机化学绝密-碳族元素ppt课件.ppt

天马****23









亲,该文档总共299页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

化学竞赛无机化学绝密-碳族元素ppt课件.ppt
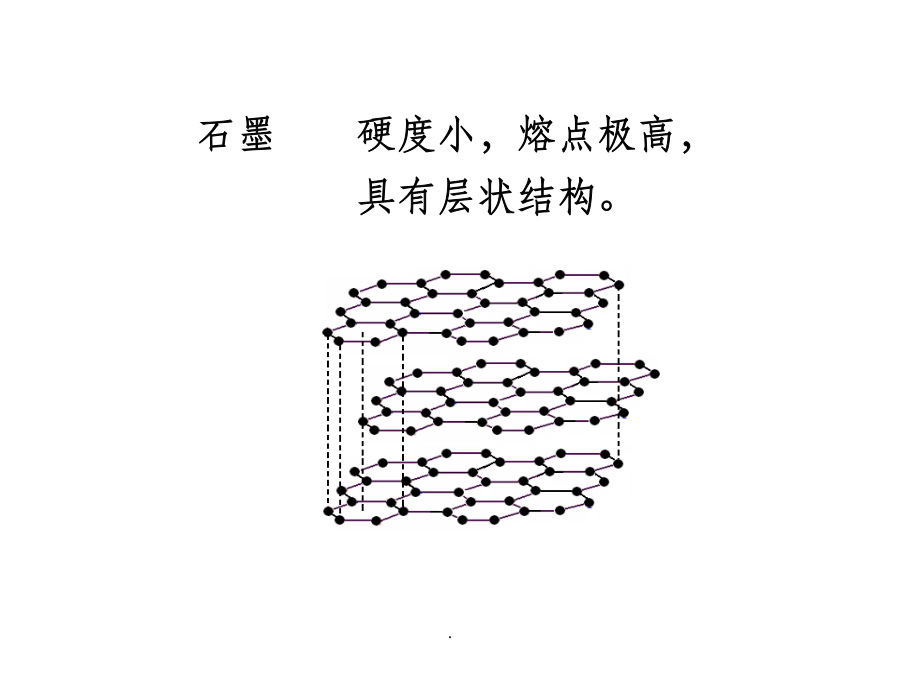
碳C无机化合物碳在地壳中的质量含量为0.048%列第15位硅Si锗Ge锡Sn铅Pb13.1碳单质石墨硬度小,熔点极高,具有层状结构。石墨中碳原子sp2杂化有离域电子,所以石墨导电。木炭和焦炭基本属于石墨类型,但是晶形不完整。金刚石硬度最大,熔点极高。由于无自由电子,故金刚石不导电。碳簇以C60为代表的碳单质的第三种同素异形体——碳簇,是20世纪80年代被人们发现的。可以从正二十面体出发正二十面体:共二十个面,每个面都是正三角形;每个面角都是五面角,共十二个顶点。将12个顶角都截掉,截口处产生12个正五边

化学竞赛无机化学绝密 碳族元素.ppt
碳C无机化合物碳在地壳中的质量含量为0.048%列第15位硅Si锗Ge锡Sn铅Pb13.1碳单质石墨硬度小,熔点极高,具有层状结构。石墨中碳原子sp2杂化有离域电子,所以石墨导电。木炭和焦炭基本属于石墨类型,但是晶形不完整。金刚石硬度最大,熔点极高。由于无自由电子,故金刚石不导电。碳簇以C60为代表的碳单质的第三种同素异形体——碳簇,是20世纪80年代被人们发现的。可以从正二十面体出发正二十面体:共二十个面,每个面都是正三角形;每个面角都是五面角,共十二个顶点。将12个顶角都截掉,截口处产生12个正五边

化学竞赛无机化学绝密-氧族元素ppt课件.ppt
氧O硫S天然单质硫矿硫酸盐矿如石膏CaSO4•2H2O芒硝Na2SO4•10H2O重晶石BaSO4天青石SrSO4硒Se硒铅矿PbSe硒铜矿CuSe碲Te碲铅矿PbTe黄碲矿TeO2钋Po放射性元素,本章不做介绍。15.1氧单质和氧化物最常见的是催化分解KClO3工业上制取O2的方法是分馏液化空气。2.氧气的性质水中少量氧气是水生动植物赖以生存的基础。54K凝固,成淡蓝色固体。(1)和大多数单质直接化合例如H2S气体点燃后在氧气充足的条件下燃烧,生成二氧化硫和水:氧气不充足时,将生成单质硫和水:NH3在氧

化学竞赛无机化学绝密-卤素ppt课件.ppt
第十六章卤素氯Cl主要以氯化钠的形式存在于海水、盐湖、盐井中。溴Br主要存在于海水中,盐湖和盐井中也存在少量的溴。碘I碘在海水中存在的更少,主要被海藻所吸收。碘也存在于某些盐井、盐湖中。南美洲智利硝石含有少许的碘酸钠。砹At砹属于放射性元素,不列为本章研究内容。16.1卤素单质F2Cl2Br2I22.颜色浅黄黄绿红棕紫为什么Cl2吸收能量高的紫光,Br2吸收能量居中的蓝绿光,而I2却吸收能量较低的黄绿光?卤素单质的双原子分子轨道图卤素吸收部分可见光,以满足电子从最高占有轨道*,向最低空轨道*跃迁所需的

化学竞赛无机化学绝密课件-卤素.ppt
第十六章卤素氯Cl主要以氯化钠的形式存在于海水、盐湖、盐井中。溴Br主要存在于海水中,盐湖和盐井中也存在少量的溴。碘I碘在海水中存在的更少,主要被海藻所吸收。碘也存在于某些盐井、盐湖中。南美洲智利硝石含有少许的碘酸钠。砹At砹属于放射性元素,不列为本章研究内容。16.1卤素单质F2Cl2Br2I22.颜色浅黄黄绿红棕紫为什么Cl2吸收能量高的紫光,Br2吸收能量居中的蓝绿光,而I2却吸收能量较低的黄绿光?卤素单质的双原子分子轨道图卤素吸收部分可见光,以满足电子从最高占有轨道*,向最低空轨道*跃迁所需的
