
在NaCl的饱和溶液中.ppt

天马****23









亲,该文档总共35页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

在NaCl的饱和溶液中.ppt
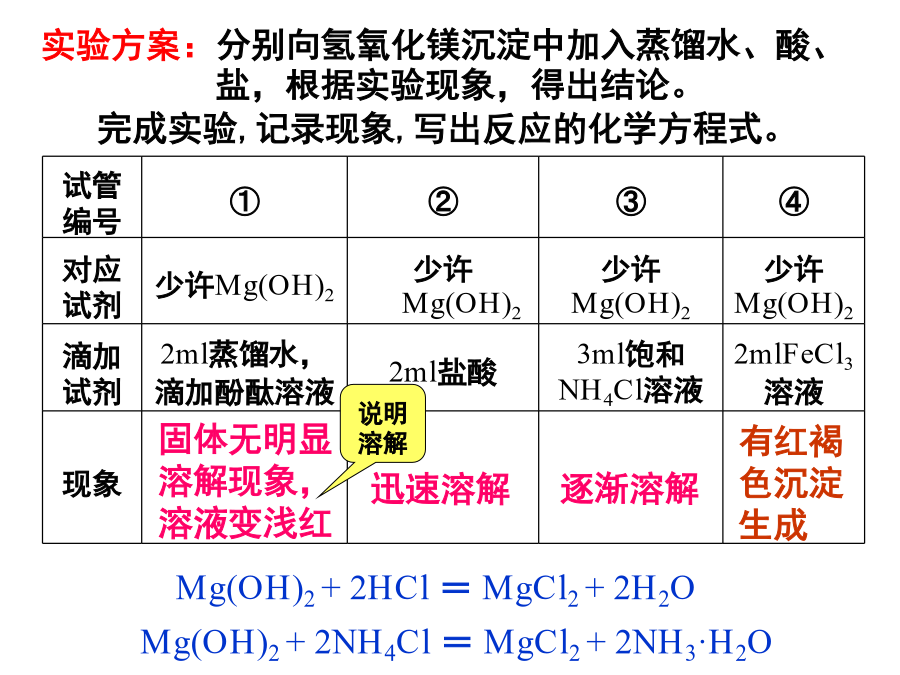
影响溶解平衡的因素:要使NaCl饱和溶液中析出NaCl固体,可采取什么措施?向饱和NaCl溶液中加入浓盐酸,是否有晶体析出?二、沉淀反应的应用(2)方法思考与交流2、沉淀的溶解[思考]:写出氢氧化镁沉淀溶解平衡的表达式.1、原理:根据勒夏特列原理,使沉淀溶解平衡向溶解方向移动试管编号在溶液中存在Mg(OH)2的溶解平衡:Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq)沉淀的转化【实验3-4】步骤沉淀的转化沉淀的转化示意图沉淀转化的实质沉淀转化的实质是沉淀溶解平衡移动。一般溶解度小的沉淀转化成溶解度

要使NaCl饱和溶液中析出NaCl固体.ppt
1、盐类的水解实质:思考与讨论可溶的电解质溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?讨论2、根据对溶解度及反应限度、化学平衡原理的认识,说明生成沉淀的离子反应是否能真正进行到底。1、生成沉淀的离子反应能发生的原因3、溶解平衡的特征石灰乳中存在下列平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq),加入下列溶液,可使Ca(OH)2减少的是()A、Na2CO3溶液B、AlCl3溶液C、NaOH溶液D、CaCl2溶液1、溶度积(Ksp):在一定温度下,在难溶电解质的饱和溶液中,各离子

家当盐中NaCl含量的测定.ppt
任务3工业盐中NaCl含量的测定能力目标知识目标学习情境3.试验程序:取25g粉碎至2mm以下的均匀样品(氯化镁不必粉碎,称40g),称准至0.001g,置于400mL烧杯中,加200mL水,加热近沸至样品全部溶解,冷却后移入500mL容量瓶,加水稀释至刻度,摇匀(必要时过滤)。从中吸取25.00mL于250mL容量瓶,加水稀释至刻度,摇匀,再吸取25.00mL(含60-70mgCI-),置于150mL烧杯中,加4滴铬酸钾指示剂,均匀搅拌下用硝酸银0.1mol/L标准溶液滴定,直至出现稳定的淡桔红色悬浊液

NaCl House.ppt
NaClHouseNaClHouseNaClHouse借鉴之处谢谢观看

NaCl、KCl晶体中阴离子扰动效应的研究.docx
NaCl、KCl晶体中阴离子扰动效应的研究NaCl和KCl是常见的离子晶体,它们的结构和组成对于其物理和化学性质具有重要影响。在纯化学的研究中,常常忽视了离子晶体中离子的运动和扰动,因为它们通常被认为是可以被计算和处理的非常规物理效应。然而,近年来,越来越多的研究表明,离子晶体中负离子的运动和扰动对于其物理性质和化学反应具有非常重要的意义。在NaCl和KCl晶体中,阴离子扰动效应主要包括两个方面:导致原子振动和晶体结构变化的外力作用;以及水分子的溶解和吸附导致的阴离子扰动和扩散。首先,外力作用是导致NaC
