
离子键与离子晶体12.ppt

天马****23









亲,该文档总共23页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

离子键与离子晶体12.ppt
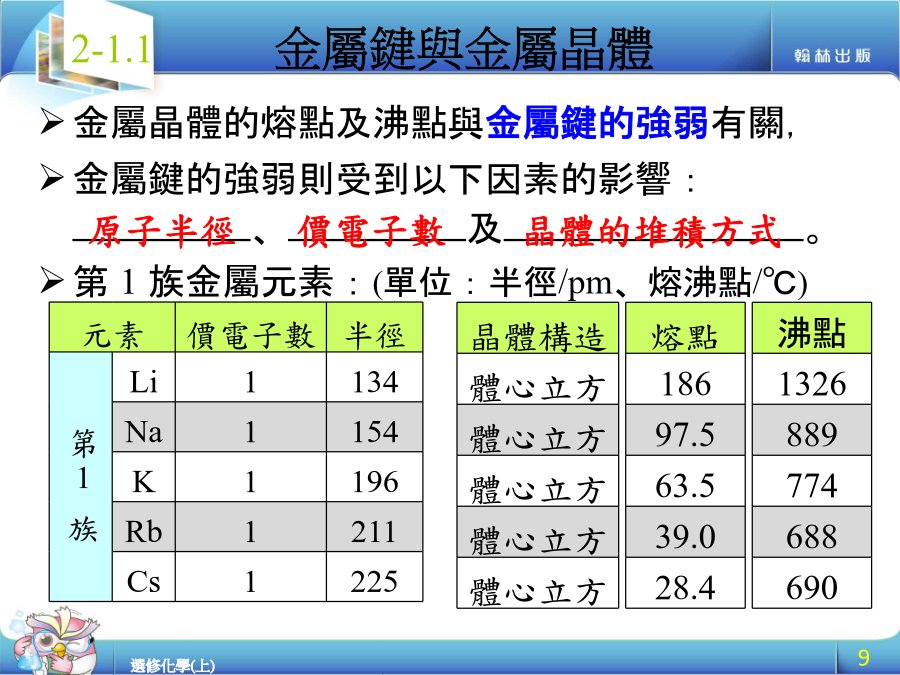
金屬鍵與離子鍵金屬鍵與離子鍵學習目標:金屬晶體是金屬原子藉由金屬鍵結合而形成的晶體。金屬原子具有以下特性:及。閱讀焦點:金屬的立方晶系堆積晶格種類晶格種類週期表中,部分金屬元素的晶體結構:金屬晶體的熔點及沸點與金屬鍵的強弱有關,金屬鍵的強弱則受到以下因素的影響:、及。第1族金屬元素:(單位:半徑/pm、熔沸點/℃)金屬晶體的熔點及沸點與金屬鍵的強弱有關,金屬鍵的強弱則受到以下因素的影響:、及。第2族金屬元素:(單位:半徑/pm、熔沸點/℃)第1族金屬元素的堆積方式皆為體心立方,故其熔點及沸點皆隨原子序的增

离子键与离子晶体12.ppt
金屬鍵與離子鍵金屬鍵與離子鍵學習目標:金屬晶體是金屬原子藉由金屬鍵結合而形成的晶體。金屬原子具有以下特性:及。閱讀焦點:金屬的立方晶系堆積晶格種類晶格種類週期表中,部分金屬元素的晶體結構:金屬晶體的熔點及沸點與金屬鍵的強弱有關,金屬鍵的強弱則受到以下因素的影響:、及。第1族金屬元素:(單位:半徑/pm、熔沸點/℃)金屬晶體的熔點及沸點與金屬鍵的強弱有關,金屬鍵的強弱則受到以下因素的影響:、及。第2族金屬元素:(單位:半徑/pm、熔沸點/℃)第1族金屬元素的堆積方式皆為體心立方,故其熔點及沸點皆隨原子序的增

离子键离子晶体.ppt
1、离子键的定义:使带相反电荷的阴、阳离子结合的相互(静电)作用静电作用指:在离子化合物中,阴、阳离子之间的静电引力使阴、阳离子相互吸引;阴离子的核外电子与阳离子的核外电子之间、阴离子的原子核与阳离子的原子核之间的静电斥力使阴、阳离子相互排斥。Na离子成键的主要原因:活泼金属最外层电子数少于4个,容易失去最外层电子而使次外层达到8个电子的稳定结构;活泼非金属最外层电子数多于4个,容易获得电子而使最外层达到8个电子的稳定结构。两者化合时,通过电子的转移形成结构相对稳定、电性相反的阴、阳离子,当阴、阳离子之间
离子键与离子晶体.ppt
離子鍵動畫:金屬與非金屬的浪漫婚禮氯化鈉的形成離子鍵的形成(NaCl為例)鈉與氯的反應氟化鈉的形成氯化鎂的形成陰、陽離子不斷靠近時,彼此間是否永遠只有吸引力?解:不是的,當陰、陽離子靠近時仍會出現兩離子間電子與電子、原子核與原子核間的斥力。典型元素形成離子典型元素形成離子時的電荷量1A族與7A族元素以離子鍵鍵結時,陽、陰離子各帶多少電荷呢?解:1A族形成+1價陽離子7A族形成-1價陰離子氫原子與其他元素化合時,若從其他元素獲得一個電子,氫也可以有與氦氣相同的電子排列。若氫以離子鍵與1A或2A族元素化合時,

离子键与离子晶体2.ppt
學習目標:大部分金屬元素和非金屬元素反應時,金屬元素易失去價電子而成為,非金屬元素則較易獲得電子,而形成。以氯化鈉(NaCl)為例:鈉離子與氯離子再藉由離子鍵,堆積成氯化鈉晶體(俗名食鹽)。氯化鈉晶體的外形為正立方體,晶體裡鈉離子、氯離子交錯排列。鎂帶在空氣中燃燒,會發出強光而生成白色的氧化鎂固體:離子化合物包括帶正電的原子團與帶負電的原子團所構成,例如:農民常用的化學肥料硫酸銨((NH4)2SO4)常見的帶電原子團:離子鍵的本質為庫侖靜電力。由陰離子與陽離子藉由離子鍵結合而形成離子晶體必為放熱。由靜電力
