
金属腐蚀原理PPT.ppt

天马****23








亲,该文档总共70页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

金属腐蚀原理PPT.ppt
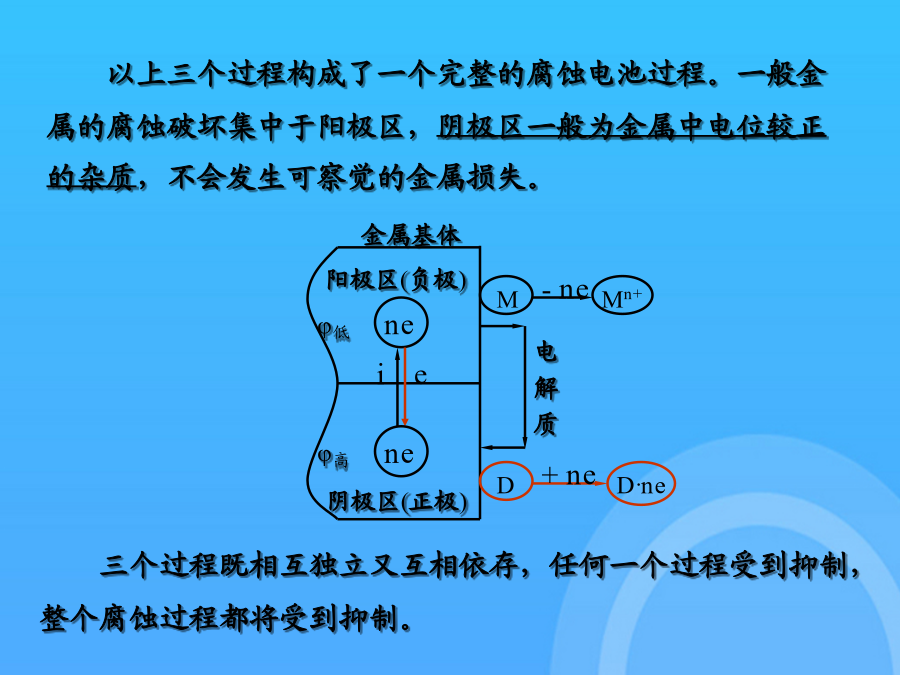
金属腐蚀原理金属为什么很容易受腐蚀?从热力学观点看,是因为金属处于不稳定状态,有与周围介质发生作用转变成金属离子的倾向。在热力学上,可以用进行相应的腐蚀反应时吉布斯函数变ΔG来衡量。化学腐蚀:单纯由于化学作用而引起的腐蚀。如高温腐蚀和无导电性的非水溶液中的腐蚀。电化学腐蚀:金属与电解质溶液接触时,由电化学氧化还原作用而引起的腐蚀。金属在大气、土壤、海水中、人体内以及绝大多数工业介质中的腐蚀都是电化学腐蚀。1.2金属腐蚀速度的表示方法(3)电流指标ia:金属电化学腐蚀过程的阳极电流密度。可以用法拉第定律将电

金属腐蚀原理绪论.pptx
目录绪论腐蚀学科:材料科学的分支交叉学科:材料-电化学,材料-力学-化学研究对象:材料、环境及其交互作用(以表面为主)研究手段:材料学、电化学、力学、表面科学腐蚀与防护工程技术:面向材料的使用或服役过程反过来影响材料设计与加工、工程设计传统腐蚀定义金属与周围环境介质之间发生的化学或电化学作用而引起腐蚀破坏;广义腐蚀定义材料和材料性质在与其所处的环境介质作用下发生退化变质的现象。腐蚀现象的本质腐蚀的特点:3腐蚀与防护研究的意义能源电力水电有水轮机组的腐蚀、叶片空蚀;火电有锅炉和管道的腐蚀;核电站高温、辐射、

金属腐蚀原理.ppt
Chapter2金属腐蚀原理金属为什么很容易受腐蚀?从热力学观点看,是因为金属处于不稳定状态,有与周围介质发生作用转变成金属离子的倾向。在热力学上,可以用进行相应的腐蚀反应时吉布斯函数变ΔG来衡量。化学腐蚀:单纯由于化学作用而引起的腐蚀。如高温腐蚀和无导电性的非水溶液中的腐蚀。电化学腐蚀:金属与电解质溶液接触时,由电化学氧化还原作用而引起的腐蚀。金属在大气、土壤、海水中、人体内以及绝大多数工业介质中的腐蚀都是电化学腐蚀。1.2金属腐蚀速度的表示方法(3)电流指标ia:金属电化学腐蚀过程的阳极电流密度。可以

金属腐蚀PPT课件.ppt
金属腐蚀课件参考书国内主要专业杂志国外主要专业杂志金属腐蚀原理(上册)耐蚀性指材料抵抗环境介质腐蚀的能力腐蚀性指环境介质腐蚀材料的强弱程度腐蚀过程的本质金属→金属化合物△G﹤0,自发过程不可逆过程腐蚀的危害经济损失包括直接损失和间接损失举例CorrosionScience(腐蚀科学)*腐蚀科学家CorrosionEngineering(腐蚀工程学)*腐蚀工程师金属腐蚀原理腐蚀控制腐蚀的分类均匀腐蚀速度的表示方法

金属腐蚀基本原理.ppt
第一章金属腐蚀基本原理第一节电极电位金属在水溶液中的腐蚀是最为常见的现象,在海水、淡水、土壤、化工生产介质中使用的金属设备或构筑物,无不受到腐蚀的侵袭。发生在水溶液中的腐蚀属于电化学腐蚀,而电化学保护正是防止电化学腐蚀的有力措施。两者的理论均以电化学为基础。依靠腐蚀原电池的作用而进行的腐蚀过程叫做电化学腐蚀。电化学腐蚀是腐蚀原电池电极反应的结果。因此,掌握腐蚀的电化学原理,对于从事电化学保护的工程技术入员来说是十分必要的。一、电极与电极电位一般认为,电子导体(金属等)与离子导体(液、固体电解质)接触,并有
