
诺贝尔学术资源网_紫外可见吸光光度法 (2).ppt

kp****93








亲,该文档总共65页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

诺贝尔学术资源网_紫外可见吸光光度法 (2).ppt
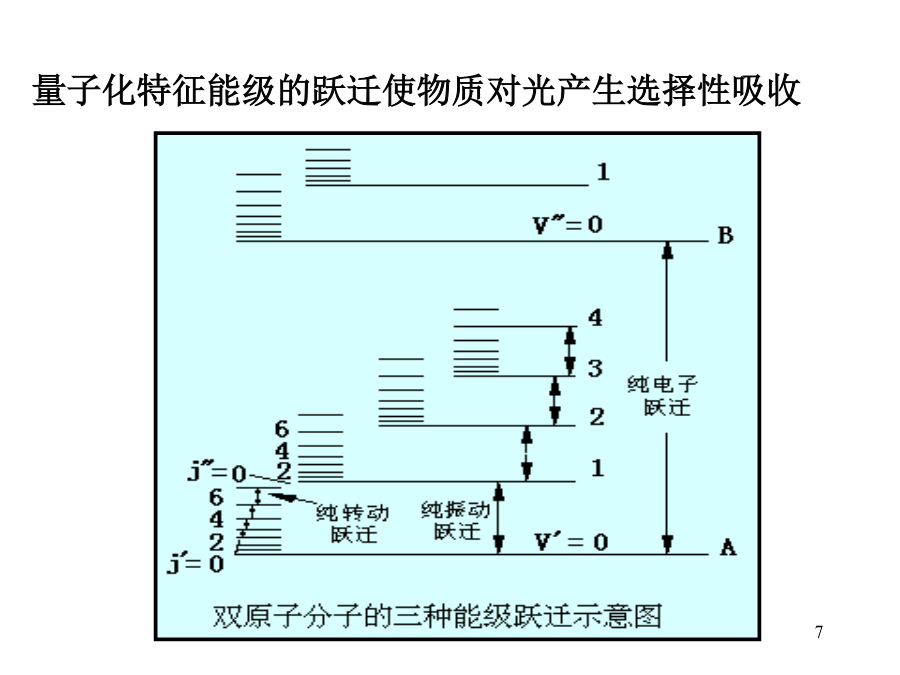
第2章可见和紫外吸光光度法22.1可见吸光光度法概述2.1.1可见吸光光度法的特点:2.1.2光的基本性质(2)光具有能量,能量是量子化的。E=E2-E1=h选择性吸收:分子结构的复杂性使其对不同波长光的吸收程度不同(E不同)。(3)计算吸收1ev能量的波长。(4)电磁波的分区。可见光区-人的眼睛能感觉到的光(380-780nm).量子化特征能级的跃迁使物质对光产生选择性吸收说明:1、可见光区是分子吸收多种能级跃迁的叠加:(1)电子能级(2)振动能级(3)转动能级2、电子能级的跃迁是带状光谱。3、分

诺贝尔学术资源网_紫外可见吸光光度法.ppt
第2章可见和紫外吸光光度法22.1可见吸光光度法概述2.1.1可见吸光光度法的特点:2.1.2光的基本性质(2)光具有能量,能量是量子化的。E=E2-E1=h选择性吸收:分子结构的复杂性使其对不同波长光的吸收程度不同(E不同)。(3)计算吸收1ev能量的波长。(4)电磁波的分区。可见光区-人的眼睛能感觉到的光(380-780nm).量子化特征能级的跃迁使物质对光产生选择性吸收说明:1、可见光区是分子吸收多种能级跃迁的叠加:(1)电子能级(2)振动能级(3)转动能级2、电子能级的跃迁是带状光谱。3、分

诺贝尔学术资源网紫外可见吸光光度法ppt课件.ppt
第2章可见和紫外吸光光度法22.1可见吸光光度法概述2.1.1可见吸光光度法的特点:2.1.2光的基本性质(2)光具有能量,能量是量子化的。E=E2-E1=h选择性吸收:分子结构的复杂性使其对不同波长光的吸收程度不同(E不同)。(3)计算吸收1ev能量的波长。(4)电磁波的分区。可见光区-人的眼睛能感觉到的光(380-780nm).2.1.3物质对光的选择性吸收2.1.4吸收曲线:物质对不同波长光的吸收特性的曲线。(2)对于不同物质,它们的吸收曲线形状和λmax则不同。(3)不同浓度的同一种物质,其

紫外可见吸光光度法.ppt
第8章紫外可见吸光光度法及分子荧光分析法化学分析:常量组分(>1%),Er:0.1%~0.2%依据化学反应,使用玻璃仪器仪器分析方法分类分子光谱学光声光谱法(PAS)PhotoAcousticSpectroscopy拉曼光谱法(RS)RamanSpectroscopy*核磁共振波谱法(NMR)NuclearMagneticResonanceSpectroscopy*质谱法(MS)MassSpectroscopy发展联用技术是趋势!8.1吸光光度法的基本原理I08.1.1光的基本性质(电磁波的波粒二象性)X

第十二章紫外可见吸光光度法习题.pdf
第⼗⼆章紫外可见吸光光度法习题第⼗⼆章紫外-可见吸光光度法习题1.是⾮判断题1-1物质的颜⾊是由于选择性地吸收了⽩光中的某些波长所致,VitB12溶液呈现红⾊是由于它吸收了⽩光中是红⾊光波。1-2因为透射光和吸收光按⼀定⽐例混合⽽成⽩光,故称这两种光为互补⾊光。1-3有⾊物质溶液只能对可见光范围内的某段波长的光有吸收。1-4符合朗伯-⽐⽿定律的某有⾊溶液的浓度越低,其透光率越⼩。1-5符合⽐⽿定律的有⾊溶液稀释时,其最⼤吸收峰的波长位置不移动,但吸收峰降低。1-6朗伯-⽐⽿定律的物理意义是:当⼀束平⾏单⾊
